
【题目】物质A-K有如图所示转化关系,其中气体D、E为单质,试回答下列问题:
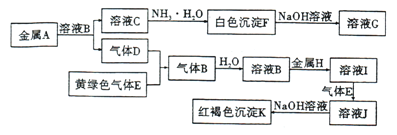
(1)写出下列物质的化学式:气体D是________,H是________.
(2)写出反应“I![]() J”的离子方程式:__________
J”的离子方程式:__________
(3)写出反应“F![]() G" 的离子方程式:____________
G" 的离子方程式:____________
(4)在溶液I中滴人NaOH溶液,可观察到的现象是_______其反应的原理是_________(写化学方程式)。
(5)检验溶液J中的金属阳离子,用_______试剂(填化学式),其现象是__________。
【答案】 H2 Fe 2Fe2++Cl2=2Fe3++2Cl- Al(OH)3+OH-=AlO2-+2H2O 先生成白色沉淀然后变为灰绿色,最后变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 KSCN 溶液变为血红色
【解析】K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,气体E是黄绿色气体判断为Cl2,D应为H2,E应为氧化性气体Cl2,B应为HCl,H为Fe,则I为FeCl2,J为FeCl3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)由以上分析可知D应为H2,H为Fe;(2)反应“I→J”是FeCl2和Cl2发生反应生成氯化亚铁,反应离子方程式为2Fe2++Cl2=2Fe3++2Cl-;(3)“F→G”的离子方程式:Al(OH)3+OH-=AlO2-+2H2O;(4)在溶液I中滴入NaOH溶液,可观察到的现象是:先出现白色沉淀,随即变成灰绿色,最后变成红褐色。其反应的原理是:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(6)检验溶液J中的金属阳离子即Fe3+,可取溶液加入KSCN溶液,溶液变为血红色,证明含有Fe3+。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空. 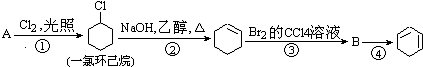
(1)A的结构简式是 , 名称是 .
(2)①的反应类型是 , ②的反应类型是 .
(3)反应④的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的操作过程中的仪器选用不正确的是( )
A.称取3g左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘单质——分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的量与加入X的物质的量的关系如下图所示,符合图示情况的是( )
| A | B | C | D |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com