
【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
【答案】30 ![]() 大于
大于 ![]() 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大 13.4
二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大 13.4
【解析】
②根据阿伏加德罗定律可知,在恒温恒容条件下,气体的压强与物质的量成正比;
③根据温度对压强和平衡状态的影响分析;
④根据五氧化二氮完全分解时的压强计算出二氧化氮、氧气的压强,然后再根据二氧化氮转化的方程式计算平衡时二氧化氮、四氧化二氮的压强;
②在恒容容器中,气体的分压和物质的量成正比,故此题中可用P代替各物质的量使用。t=62min时,![]() =2.9 kPa,因此
=2.9 kPa,因此![]() =(35.8-2×2.9)kPa=30.0 kPa,
=(35.8-2×2.9)kPa=30.0 kPa, ![]() ,故答案为:30;
,故答案为:30;![]() ;
;
③根据pV=nRT,恒容容器中,升高温度,T增大,所以总压强P增大。![]() 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,因此总压强大于63.1kPa,故答案为:大于;
二聚为放热反应,温度提高,平衡左移,体系物质的量增加,因此总压强大于63.1kPa,故答案为:大于;![]() 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大;
二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强P增大;
④根据题中63.1kPa数值,![]() ,所以
,所以![]() 。根据反应前后氮原子守恒可知:
。根据反应前后氮原子守恒可知:![]() ,解得
,解得![]() ,
,![]() ,
, 。故答案为13.4。
。故答案为13.4。


科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
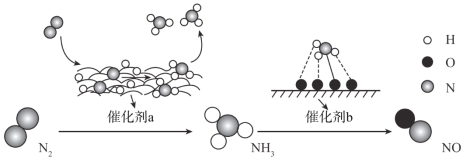
下列叙述正确的是
A.N2![]() NH3,NH3
NH3,NH3![]() NO均属于氮的固定
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为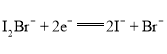
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。

(1)从装置的特点判断,甲、乙装置中___________是原电池,其负极的电极反应式为:_______________;
(2)实验开始后,(乙)装置中有关电极反应是:C:___________________;D:__________________,D电极上的现象是_____________,一段时间后溶液中的现象是________________;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为:__________________,乙装置里除两电极上有明显的现象外,还可以看到的现象是__________________,产生该现象的化学反应方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
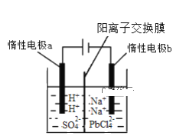
①写出电解时阴极的电极反应式_____________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________极室(填“阴”或者“阳”)加入____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.含1mol/LC1-的NH4Cl与氨水的中性混合溶液中,NH4+数为NA
B.60gSiO2和28gSi中各含有4NA个Si-O键和4NA个Si-Si键
C.标准状况下,浓盐酸分别与MnO2、KClO3反应制备22.4LCl2,转移的电子数均为2NA
D.10g46%甲酸(HCOOH)水溶液所含的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,它们分别位于三个不同的周期。常温下,元素W与X可形成两种液态物质;Y、Z两种元素可组成二聚气态分子(如图所示),其中Y原子的最外层电子数等于其电子层数。下列叙述不正确的是( )

A.W与Z具有相同的负化合价
B.四种元素的简单离子半径由大到小的顺序:Z>Y>X>W
C.Y2Z6分子中所有原子的最外层均满足8电子稳定结构
D.工业上可电解X与Y形成的熔融化合物制取Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是
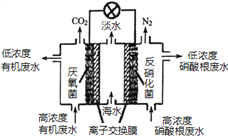
A. 该电池能在高温下工作
B. 该电池工作时,中间室中的Cl-移向右室
C. 正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2 ↑+ 12OH-
D. 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6 转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
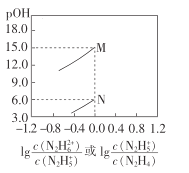
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com