
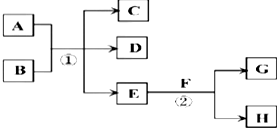
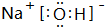 .
.分析 (1)E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成常见的无色气体G,应是过氧化钠与水反应生成氢氧化钠与氧气,则E为H2O,F为Na2O2,G为O2,H为NaOH;
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则A为C,B为浓硫酸,C为二氧化硫,D为二氧化碳;
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,则D为氨气,且B遇盐酸产生能使品红溶液褪色的气体,则B为亚硫酸氢铵.
解答 解:(1)E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成常见的无色气体G,应是过氧化钠与水反应生成氢氧化钠与氧气,则E为H2O,F为Na2O2,G为O2,H为NaOH,NaOH的电子式为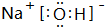 ,
,
故答案为: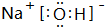 ;
;
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则A为C,B为浓硫酸,C为二氧化硫,D为二氧化碳,则反应①的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,用无水硫酸铜检验水蒸气,用品红溶液检验二氧化硫,用石灰水检验二氧化碳,由于气体加热溶液中会带出水蒸气,故先检验水蒸气,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;H2O;无水硫酸铜粉末;
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,则D为氨气,且B遇盐酸产生能使品红溶液褪色的气体,则B为亚硫酸氢铵,在加热条件下,当A过量时,反应①的离子方程式是:2OH-+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-,
故答案为:2OH-+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-.
点评 本题考查无机物的推断,物质的颜色、气味、状态及特殊性质是推断突破口,熟练掌握元素化合物知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为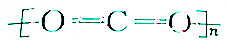 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.0gCuO和Cu2S的混合物含铜离子个数为0.05NA | |
| B. | 标准状况下,11.2LC5H12蒸气所含甲基数目最多为NA | |
| C. | 0.5molK与O2完全反应生成K2O,K2O2,KO3的混合物,转移电子数为0.5NA | |
| D. | 1L 0.2mol•L-1HI溶液中含I-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g${\;}_{\;}^{18}$O3中含有的中子数为10NA | |
| B. | 密闭条件下,2molSO2和1molO2在密闭容器中充分反应后容器中的分子数大于2NA | |
| C. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| D. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑,若有5molH2O参加反应,则被谁还原BrF3的分子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.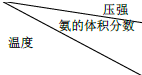 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com