
【题目】氮、磷是生物体中不可缺少的元素,它们能形成多种化合物。
(1)基态氮原子的价层电子排布图为___________。
(2)NF3的键角小于NH3的原因是__________________。
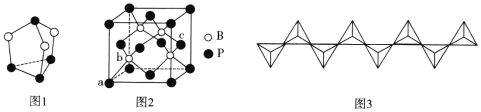
(3)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构。
①该化合物的分子式为______________,分子中硫原子的杂化轨道类型为____________________。
②磷的第一电离能大于硫的原因是________________________。
(4)PCl5中P—Cl键长有198pm和206 pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,阴离子的化学式为_________________。
(5)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
(6)某直链多磷酸钠的阴离子呈如图3所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为________________。
【答案】![]() F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度 P4S3 sp3 磷原子3p轨道处于半充满状态,不易失去电子 PCl6- (
F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度 P4S3 sp3 磷原子3p轨道处于半充满状态,不易失去电子 PCl6- (![]() ,
,![]() ,
,![]() )
) ![]() NaPO3或(NaPO3)n
NaPO3或(NaPO3)n
【解析】
(1)基态氮原子的价电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图;
(2)从元素的电负性及电子云的密度大小及排斥作用力分析;
(3)①根据分子示意图,结合S、P原子最外层电子数及形成电子对数判断;从S原子具有的电子对数分析其杂化轨道类型;
②原子核外电子所处轨道为全满、半满或全空时体系能量低,稳定;
(4)根据正八面体、正四面体的构型分析其电离方式,从而判断微粒的结构;
(5)根据a、c点坐标参数可知,以晶胞a点为坐标原点建立空间直角坐标系,注意到b在该晶胞分成的8个立方体中的一个几何中心上,然后分析、判断;先计算每个晶胞中含有的P、B原子数,再计算晶胞的边长,最后根据![]() 计算晶胞的密度;
计算晶胞的密度;
(6) P原子周围有4个O原子,其中2个氧原子分别为2个四面体结构共用,每个P与3个O形成阴离子,且P的化合价为+5价,再计算阴离子化合价判断化学式。
(1)基态氮原子的价电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图为![]() ;
;
(2) NF3的键角小于NH3是由于F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度,排斥作用减弱,故键角小;
(3)①P原子最外层有5个电子,达到8个电子的稳定结构要形成三对共用电子对;而S原子P原子最外层有6个电子,达到8个电子的稳定结构要形成两对共用电子对,所以图示中黑球表示P原子,白球表示S原子,该物质的分子式为P4S3;在P4S3分子中形成2个共键单键,且S上有2个孤电子对,因此P4S3分子中硫原子的杂化轨道类型为sp3杂化;
②P原子的3p电子处于该轨道的半充满的稳定状态,所以失去一个电子比电子不处于半满的稳定状态需要的能量高,因此磷的第一电离能大于硫;
(4) PCl5是非极性分子,可作为导电熔体,形成一种能导电的熔体,说明生成自由移动的阴阳离子,阴离子为正八面体,阳离子为正四面体,正四面体形阳离子为PCl4+、正六面体形阴离子是PCl6-,发生的电离反应式为:2PCl5=PCl4++PCl6-,故阴离子的化学式为PCl6-;
(5)由a、c两点的坐标参数可知:以晶胞a点为坐标原点建立空间直角坐标系,将该晶胞等分为8个小立方体,注意到b点在左下角靠近a点的小立方体的几何中心上,根据立体几何知识以及对称性,不难判断b的原子坐标在各个坐标轴上的分量为![]() ,所以其坐标参数为(
,所以其坐标参数为(![]() ,
,![]() ,
,![]() );在一个晶胞中含有的B原子数为4个,含有的P原子数为:8×
);在一个晶胞中含有的B原子数为4个,含有的P原子数为:8×![]() +6×
+6×![]() =4,晶胞的质量为m=
=4,晶胞的质量为m=![]() g,该晶胞中距离最近的两个磷原子的核间距离为d nm,处于晶胞面对角线一半的位置,所以晶胞的边长L=
g,该晶胞中距离最近的两个磷原子的核间距离为d nm,处于晶胞面对角线一半的位置,所以晶胞的边长L=![]() nm=
nm=![]() ×10-7cm,该晶胞的体积为V=L3=(
×10-7cm,该晶胞的体积为V=L3=(![]() ×10-7cm)3=
×10-7cm)3=![]() cm3,因此该晶胞的密度
cm3,因此该晶胞的密度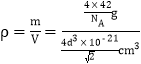 =
=![]() g/cm3;
g/cm3;
(6) P原子周围有4个O原子,其中2个氧原子分别为2个四面体结构共用,故每个P完全与3个O形成阴离子,且P的化合价为+5价,阴离子化合价为+5+3×(-2)= -1,故该该多磷酸钠的化学式为(NaPO3)n或写为NaPO3。


科目:高中化学 来源: 题型:
【题目】Ⅰ\(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化剂及军事科学中。所谓“纳米材料”是指研究、开发出的微粒直径从几纳米到几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ____。
A.能全部透过滤纸 B.有丁达尔效应 C.所得液体呈胶状 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是__________。
(3)把少量的FeCl3饱和溶液滴入沸水中,制成Fe(OH)3胶体后滴入少量稀硫酸可观察到的现象是:__,继续滴加至稀硫酸过量可观察到的现象是_____,写出上述反应的化学方程式____。
Ⅱ\给下图①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。
(1)请推断它们的化学式分别为:②______,③ ______,⑤_______。
(2)写出下列序号之间的化学方程式:①和②:_______________,②和④:____________,③和④:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是
A. 中和反应是吸热反应B. 燃烧属于放热反应
C. 化学键断裂放出能量D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用 过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度_______________;
(2)产生的气体在标准状况下的体积_____________。(要有过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。电池工作时电极上发生的反应为:
![]()
下列关于该电池的叙述正确的是
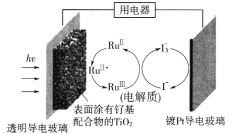
A. 电池工作时,是将化学能转化为电能
B. 电池工作时,电解质溶液中I-和I3-浓度不断减少
C. 透明导电玻璃上的电势比镀Pt导电玻璃上的电势高
D. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为电解饱和食盐水的简易装置,下列有关说法正确的是:
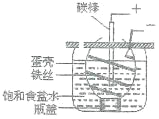
A. 电解一段时间后往蛋壳中滴加几滴酚酞,呈红色
B. 蛋壳表面缠绕铁丝是阳极
C. 铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D. 蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
科目:高中化学 来源: 题型:
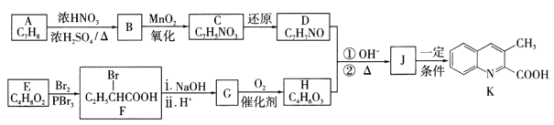
【题目】某药物中间体K的一种合成路线如下。
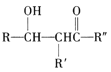
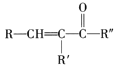
已知:RNH2+![]()
![]()
![]() +H2O
+H2O
![]() +
+![]()
![]()
![]()
(1)A→B的反应类型是____________,D中含有的官能团名称是________________。
(2)E的化学名称是________________,K的分子式是__________________________。
(3)F与足量NaOH溶液反应的化学方程式为_________________________________。
(4)J的结构简式为______________________。
(5)G的同分异构体中能同时满足下列条件的共有______种(不含立体异构):
①能与金属钠反应产生气体 ②既能发生银镜反应,又能发生水解反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是___________(写结构简式)。
(6)季戊四醇(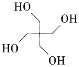 )是重要的化工原料。设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)________________________。
)是重要的化工原料。设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.元素周期表是元素按相对原子质量大小排列而成的
B.元素周期表共有9个周期和18个族
C.在金属元素与非金属元素的分界线附近寻找半导体材料
D.第IA族元素,原子序数越大,金属性越弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是
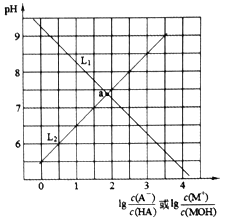
A. 曲线L1表示![]() 与pH的变化关系
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.01mol·L-1MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com