
分析 根据氧化还原反应中得失电子数相等配平,即找到元素化合价升降的数目,求得最小公倍数,让化合价升降总数相等,从而确定氧化剂与还原剂计量数之比,再利用原子守恒和电荷守恒配平方程式.
解答 解:(1)KI+KIO3+H2SO4→I2+K2SO4+H2O,碘化钾中碘元素的化合价从-1价升高到0价,升高了1价,碘酸钾中碘元素的化合价从+5价降到0价,降低了5价,则碘化钾与碘酸钾计量数之比为5:1,根据原子守恒配平方程式为:5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O,
故答案为:5;1;3;3;3;3;
(2)MnO4-+H++Cl-→Mn2++Cl2↑+H2O,锰元素的化合价从+7价降到+2价,降了5价,氯元素的化合价从-1价升高到0价,2个氯离子产生1个氯气则升高2价,故高锰酸根与氯气计量数之比为2:5,氯离子的计量数为10,二价锰离子的计量数为2,根据电荷守恒氢离子的计量数应为16,水的计量数为8,配平离子方程式为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:2;16;10;2;5;8;
(3)P4+KOH+H2O→K3PO4+PH3,白磷分子中磷元素的化合价从0价上升到+5价,升高了5价,又降低到-3价,降了3价,则K3PO4与PH3计量数之比为3:5,所以P4的计量数为2,根据原子守恒配平方程式为:2P4+9KOH+3H2O═3K3PO4+5PH3,
故答案为:2;9;3;3;5;
(4)ClO-+Fe(OH)3+→Cl-+FeO42-+H2O,氯元素的化合价从+1价降到-1价,降了2价,铁的化合价从+3价升到+6价,升高了3价,则ClO-和Fe(OH)3的计量数之比为3:2,根据氯原子、铁原子守恒确定出Cl-和FeO42-的计量数分别为3、2,方程式左边有3个负电荷,右边有7个负电荷,根据电荷守恒可确定出反应物还有4个OH-,配平离子方程式为:3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,
故答案为:3;2;4OH-;3;2;5.
点评 本题考查了氧化还原反应方程式或离子方程式的配平,根据氧化还原反应中得失电子数相等配平即可,注意氧化剂、还原剂是同一种物质时,从生成物开始配平更容易些,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
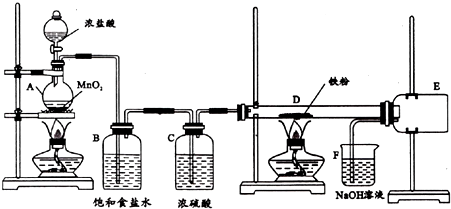
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
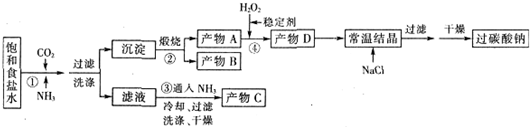
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
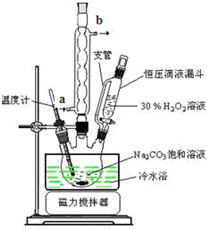
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
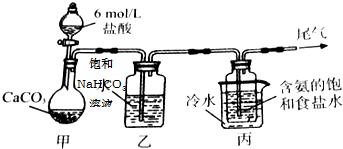
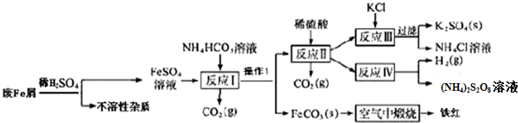
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质的性质 | 实际应用 |
| A | 二氧化锰具有强氧化性 | 用作H2O2分解的氧化剂 |
| B | 液氨汽化时要吸收大量的热 | 用作制冷剂 |
| C | Al2O3熔点高 | 用作耐高温材料 |
| D | 肥皂水显碱性 | 用作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ①②③⑤⑥⑦ | C. | ①②③④ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
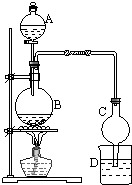 (1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.
(1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com