
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
分析 A.根据可逆反应的限度分析;
B.可逆反应达到平衡后,不同物质的正逆反应速率之比等于计量数之比;
C.根据可逆反应的特征分析;
D.在工业合成SO3时,既要考虑反应时间又要考虑转化率.
解答 解:A.可逆反应正逆反应速率相等时,反应达到最大限度,即化学平衡状态,所以反应物不能全部转化为生成物,即SO2和O2不能全部转化为SO3,故A错误;
B.该反应达到平衡后,SO2和SO3的正逆速率之比等于计量数之比,消耗1molSO2表示正速率,消耗1molSO3表示逆速率,故B正确;
C.由于反应为可逆反应,在达到平衡的体系中,充入由18O原子组成的O2后,SO2、O2、SO3中18O都出现,故C正确;
D.在工业合成SO3时,既要考虑反应时间又要考虑转化率,即要同时考虑反应速率和反应能达到的限度两方面的问题,故D正确.
故选A.
点评 本题考查了可逆反应和化学平衡状态的判断等知识点,题目难度不大,注意可逆反应达到平衡状态时,不同物质的正逆反应速率之比等于计量数之比,侧重于考查学生对基础知识的应用能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:解答题
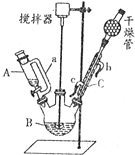 丙烯酸乙酯(CH2═CHCOOCH2CH3,密度为0.94g/mL)可广泛用于涂料、粘合剂的制造、皮革加工等方面.某实验小组利用如图所示的装置合成丙烯酸乙酯(部分夹持及加热装置已省略).
丙烯酸乙酯(CH2═CHCOOCH2CH3,密度为0.94g/mL)可广泛用于涂料、粘合剂的制造、皮革加工等方面.某实验小组利用如图所示的装置合成丙烯酸乙酯(部分夹持及加热装置已省略).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: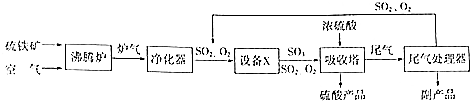 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就停止了,即正逆反应速率为零 | |
| C. | 在达到平衡的体系中,充入O2,对化学平衡无影响 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应所能达到的限度两个方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 无论如何增大H2浓度,都不能使N2转化率达到100% | |
| D. | 缩小体积,υ正增大,υ逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
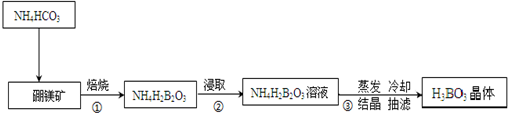
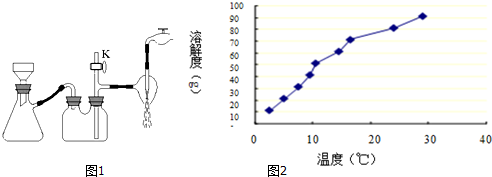
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
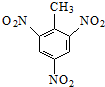 的系统命名:2,4,6-三硝基甲苯;
的系统命名:2,4,6-三硝基甲苯;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
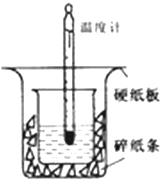 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com