
【题目】在水体中部分含氮有机物循环如图1所示.
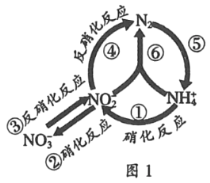

(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____kJmol﹣1
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mgL﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____.
②向三颈烧瓶中通入N2的目的是____.
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
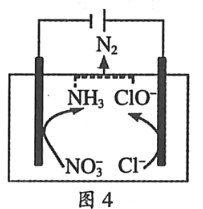
①电解时,阴极的电极反应式为_____.
②溶液中逸出N2的离子方程式为_____.
【答案】⑤ -351 8mol 驱除三颈烧瓶装置中的O2,防止铁粉被O2氧气 铁发生腐蚀消耗H+ 4Fe+NO3﹣+5H2O+2H+=4Fe(OH)2+NH4+ NO3﹣+6H2O+8e﹣=NH3+9OH﹣ 2NH3+3ClO﹣=N2+3Cl﹣+3H2O
【解析】
(1)将游离态的氮(即氮气)转化为化合态的氮(即氮的化合物)的过程,叫做氮的固定;(2)依据盖斯定律计算反应热;(3)反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价﹣1价升高为0价;加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式;(4)电解池中阴极上是NO3﹣被还原为NH3,失电子发生还原反应;氨气被次氯酸根离子氧化生成氮气,结合电荷守恒和原子守恒配平书写离子方程式。
(1)分析转化关系可知,氮的固定是指单质变化为化合物的反应,所以图中属于氮的固定的是⑤,故答案为:⑤;
(2)①2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
②2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
依据盖斯定律计算(①+②)×![]() 得到反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=﹣351kJ/mol,故答案为:﹣351;
得到反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=﹣351kJ/mol,故答案为:﹣351;
(3)①反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价﹣1价升高为0价,生成1molFe电子转移8mol,故答案为:8mol;
②向三颈烧瓶中通入N2的目的是将装置内的空气排出,防止铁粉被氧化,故答案为:驱除三颈烧瓶装置中的O2,防止铁粉被O2氧气;
③加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平离子方程式为:4Fe+NO3﹣+5H2O+2H+=4Fe(OH)2+NH4+,故答案为:铁发生腐蚀消耗H+,4Fe+NO3﹣+5H2O+2H+=4Fe(OH)2+NH4+;
(4)①电解池中阴极上NO3﹣被还原为NH3,发生还原反应,电极反应为NO3﹣+6H2O+8e﹣=NH3+9OH﹣,故答案为:NO3﹣+6H2O+8e﹣=NH3+9OH﹣;
②氨气被次氯酸根离子氧化生成氮气,反应的离子方程式为:2NH3+3ClO﹣=N2+3Cl﹣+3H2O,
故答案为:2NH3+3ClO﹣=N2+3Cl﹣+3H2O。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物NOx(主要指NO和NO2)会形成酸雨、光化学烟雾,破坏臭氧层,是大气主要污染物之一,有效去除大气中的NOx是环境保护的重要课题。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
②为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内υ(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后NO的转化率α1=____。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”)。
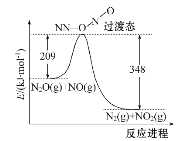
(2)NO能与N2O反应生成N2和NO2,反应的能量变化如下图所示,若生成1 mol N2,其ΔH=____kJ·mol-1。
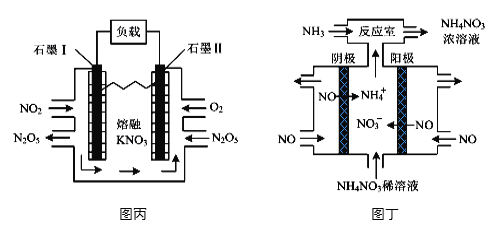
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为______________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂为________。
(4)利用电化学装置可消除氮氧化物污染,变废为宝。图丙装置实现的能量转化形式是_______。图丁为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是

A. 反应前后装置内空气的成分保持不变
B. 反应前装置内钠与Ag2O物质的量之比为2:1
C. 热稳定性:生成的钠的氧化物强于Ag2O
D. 反应后有淡黄色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A.氢氧化铁胶体制备的化学方程式为:FeCl3+H2O![]() Fe(OH) 3 ↓+3HCl
Fe(OH) 3 ↓+3HCl
B.在硫酸氢钾溶液中加入Ba(OH)2溶液至过量:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.少量氯气通入溴化亚铁溶液中:Cl2+2Br- =Br2+2Cl-
D.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一块未打磨过的铝片放入装有少量NaOH溶液的试管中,会发现开始没有气泡,一段时间后才产生气泡。请写出发生反应的离子方程式:___________,___________。
(2)将8gFe2O3投入到150mL某浓度的稀H2SO4中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe与Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为________。
(3)请写出制备漂白粉的离子方程式:____________。
(4)配平下列离子方程式:______Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol/LB.0.4( 2a-b)mol/L
C.10(b-2a)mol/LD.4(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com