
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。下列说法不正确的是
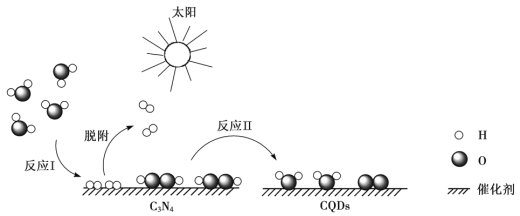
A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应I中涉及到非极性键的断裂和极性键的形成
C. 反应II为:2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D. 总反应为:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
【答案】B
【解析】
由题给反应机理图示可知,利用太阳光实现高效分解水的过程分为两步,反应I为水在C3N4做催化剂作用下反应生成过氧化氢和氢气,反应的化学方程式为2H2O![]() =H2O2+H2↑,反应II为H2O2在CQDs做催化剂作用下反应生成水和氧气,反应的化学方程式为2H2O2
=H2O2+H2↑,反应II为H2O2在CQDs做催化剂作用下反应生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O +O2↑,总反应方程式为2H2O
2H2O +O2↑,总反应方程式为2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。
A项、该过程利用太阳光实现高效分解水,实现了太阳能向化学能的转化,故A正确;
B项、反应I为水在C3N4做催化剂作用下反应生成过氧化氢和氢气,没有涉及到非极性键的断裂,故B错误;
C项、反应II为H2O2在CQDs做催化剂作用下反应生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O +O2↑,故C正确;
2H2O +O2↑,故C正确;
D项、反应I的化学方程式为2H2O![]() =H2O2+H2↑,反应II的化学方程式为2H2O2
=H2O2+H2↑,反应II的化学方程式为2H2O2![]() 2H2O +O2↑,则总反应方程式为2H2O
2H2O +O2↑,则总反应方程式为2H2O![]() 2H2↑+O2↑,故D正确;
2H2↑+O2↑,故D正确;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯化钾溶液常用作利尿剂及防治缺钾症的药物,某医疗实验小组需要用到480 mL物质的量浓度为0.5 mol·L-1的氯化钾溶液。回答下列问题:
(1)配制该溶液,需称量氯化钾晶体的质量是________。
(2)配制上述氯化钾溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、________、________。
(3)如图Ⅰ表示10 mL量筒中液面的位置,刻度A与B,B与C间均相差1 mL,如果刻度A为9,则量筒中液体的体积是________mL。

(4)定容时,某同学操作示意图如图Ⅱ所示,则其所配氯化钾溶液的浓度________(填“大于”“等于”或“小于”)0.5 mol·L-1;某同学由于操作不慎,定容时导致液面高于刻度线,他立即用胶头滴管将液体吸出,使液面恰好达到刻度线,请你评价该同学的做法:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 2 L 密闭容器中,A、B、C 三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
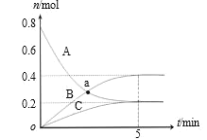
A.反应开始到 5min,υ(C)=0.2 mol/(L·min)
B.反应开始到 5min,B 的物质的量浓度增加了 0.4 mol/L
C.反应的化学方程式为:2B(g)+C(g)![]() 3A(g)
3A(g)
D.a 点时,c(A)=c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
B. 通过构成原电池,能将反应的化学能全部转化为电能
C. 如图原电池中,电池工作时,SO42-移向电池的正极
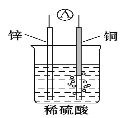
D. 构成原电池的两个电极必须是活泼性不同的两种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 2.8×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_____。
(2)氨是制备氮肥、硝酸等的重要原料
①已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式_____。
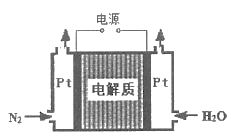
②某电解法制氨的装置如图所示,电解质只允许质子通过,试写出阴极的电极反应式_____。
(3)反应:2NO(g)+O2(g) ![]() 2NO2(g)△H<0 是制备硝酸过程中的一个反应。
2NO2(g)△H<0 是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为 2:1 置于恒温恒容密闭容器中进行上述反 应,得到NO2 体积分数与时间的关系如图所示。保持其它条件不变,t1 时再向 容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2 时再次达到平 衡,请画出 tl-t3 时间范围内 NO2 体积分数随时间的变化曲线:_________。

②在研究此反应速率与温度的关系时发现,NO 转化成 NO2 的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I.2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II.N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO 转化成 NO2 的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下 0.lmol/L 的 CH3COONH4 溶液中,c(CH3COO-):c(NH3·H2O)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水资源利用的部分过程。
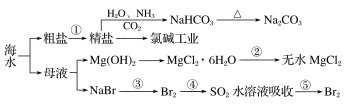
下列有关说法正确的是
A.工业上通过电解饱和MgCl2溶液制取金属镁
B.含氮、磷的大量废水排入海洋,易引发赤潮
C.反应④的离子方程式为:Br2+SO2+2H2O=2HBr+2H++ SO42-
D.在第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
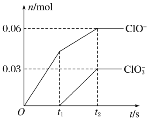
A. 苛性钾溶液中KOH的物质的量是0.09 mol
B. ClO3-的生成是由氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO3-可生成Cl2
D. 反应中转移电子的物质的量是0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
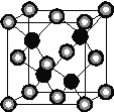
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com