
| A. | ①④ | B. | ①⑥ | C. | ②④ | D. | 只有① |
分析 ①pH试纸变成深蓝色的溶液,显碱性;
②含有大量S2-的溶液,具有还原性;
③离子之间相互促进水解;
④中性溶液不能大量存在Fe3+;
⑤加入铝粉放出氢气的溶液,为非氧化性酸或强碱溶液;
⑥离子之间相互促进水解.
解答 解:①pH试纸变成深蓝色的溶液,显碱性,该组离子之间不反应,可大量共存,故正确;
②含有大量S2-的溶液,具有还原性,不能存在氧化性的离子ClO-,故错误;
③AlO2-、A13+相互促进水解,不能大量共存,故错误;
④铁离子在pH为4.4左右沉淀完全,则中性溶液不能大量存在Fe3+,故错误;
⑤加入铝粉放出氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故错误;
⑥A13+、HCO3-相互促进水解,不能大量共存,故错误;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、水解反应及氧化还原反应的离子共存及分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
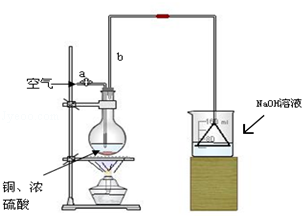 某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 实验室制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
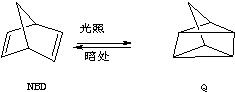 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1| A. | △H1>△H2 | B. | 等质量NBD的能量比Q的能量高 | ||
| C. | NBD比Q稳定 | D. | NBD转化为Q是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
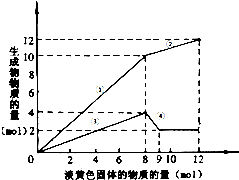 某溶液中可能含有Fe2十、Mg2+、Cu2+、NH4+、Al3+.当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.
某溶液中可能含有Fe2十、Mg2+、Cu2+、NH4+、Al3+.当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com