
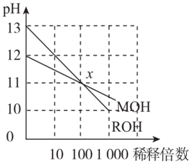
| A. | ROH是一种强碱,MOH是一种弱碱 | |
| B. | 等浓度的MOH与盐酸反应,所得溶液呈中性,则V(MOH)>V(盐酸) | |
| C. | 在x点,c(M+)=c(R+) | |
| D. | 稀释前,c(ROH)=10c(MOH) |
分析 由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,并根据酸碱中和及电离来解答.
解答 解:A.ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,故A正确;
B.MOH为弱碱,等物质的量浓度的MOH与盐酸反应,假设等体积的两种物质反应,则所得溶液呈酸性,要使所得溶液呈中性,则碱应该稍微过量,所以碱的体积应该大于酸,故B正确;
C.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故C正确;
D.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故D错误;
故选D.
点评 本题考查电解质在水中的电离及图象,明确图象中pH的变化及交点的意义是解答本题的关键,题目难度不大,侧重于考查学生对信息的提取和应用能力.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由同种元素组成的物质是单质,由多种元素组成的物质是混合物 | |
| C. | 酸性氧化物一定是非金属氧化物,非金属氧化物一定是酸性氧化物 | |
| D. | 溶液、胶体、浊液一定都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+ ${NH}_{4}^{+}$ HCO${\;}_{3}^{-}$ Cl- | |
| B. | 含有大量ClO-的溶液中:K+ OH- Na+ ${SO}_{3}^{2-}$ | |
| C. | c(Al3+)=0.1 mol?L-1的溶液中:Na+ NO${\;}_{3}^{-}$ AlO${\;}_{2}^{-}$ ${SO}_{4}^{2-}$ | |
| D. | 澄清透明的溶液中:Cu2+ Fe3+ NO${\;}_{3}^{-}$ Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 由水电离的c (H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++3ClO-+SO2+H2O═CaSO4+2HClO+Cl- | |
| B. | 向偏铝酸钠溶液中通入少量的二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向硅酸钠水溶液中通入少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通入少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com