
分析 (1)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;
(2)根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;电解质在水中不能完全电离的为弱电解质,包括弱酸、弱碱、水;
(3)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(4)电解质在水中能完全电离的为强电解质,包括强酸、强碱、大部分盐;
(5)碳酸氢钠晶体溶于水完全电离生成钠离子和碳酸氢根离子,BaSO4 在水溶液中溶解度不大但溶解的全部电离;
解答 解:(1)⑤铜中有自由电子,所以能导电;⑦熔化的KCl中有自由移动的离子,所以能导电;⑧NaOH溶液中有自由移动的离子,所以能导电;
①碳酸氢钠晶体;②液态SO2;③纯醋酸;④BaSO4;⑥乙醇;⑨氯气;⑩蔗糖没有自由移动的离子或自由电子,所以不能导电;
故答案为:⑤⑦⑧;
(2)③纯醋酸中没有自由移动的离子,不能导电,但其符合水溶液能导电的化合物,则属于电解质,又在水中不能完全电离,则属于弱电解质,
故答案为:③;
(3)非电解质包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等),所以②液态SO2中没有自由移动的离子,不导电,在水中发生电离不是其本身,则属于非电解质;
⑥酒精中不存在带电微粒,不导电,且是在水溶液中和熔化状态下都不能导电的化合物,则属于非电解质;
⑩蔗糖(C12H22O11)中不存在带电微粒,不导电,且是在水溶液中和熔化状态下都不能导电的化合物,是非电解质;
故答案为:②⑥⑩;
(4)强电解质,包括强酸、强碱、大部分盐,①氯化钠晶体属于盐;④BaSO4属于盐;⑦熔化的KCl属于盐;
故答案为:①④⑦;
(5)碳酸氢钠晶体溶于水完全电离生成钠离子和碳酸氢根离子,电离方程式为:NaHCO3=Na++HCO3-,BaSO4 在水溶液中溶解度不大但溶解的全部电离,电离方程式为:BaSO4=Ba2++SO42-,
故答案为:NaHCO3=Na++HCO3-;BaSO4=Ba2++SO42-;
点评 本题考查了电解质与非电解质的定义以及物质的导电性的判断,侧重考查学生的辨别能力,根据电离的程度来判断强弱电解质是解答的关键,要注意的是:电解质不一定导电,如BaSO4固体;导电的不一定是电解质,如铜,题目难度不大.


科目:高中化学 来源: 题型:推断题
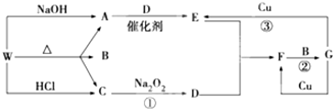
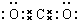 ,F的颜色红棕色.
,F的颜色红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↓+H2 | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| D. | 硫酸氢铵与少量氢氧化钠溶液混合:NH4++HSO4-+2OH-═SO42-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,5-二甲基己烷的核磁氢谱中出现三组峰 | |
| B. | 丙烷分子的比例模型: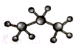 | |
| C. | 四氯化碳分子的电子式: | |
| D. | 化合物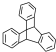 是苯的同系物 是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式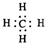 | |
| B. | 氟化钠的电子式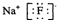 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子 ${\;}_6^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤出的固体中一定含有银和铜,一定不含镁 | |
| B. | 滤出的固体中一定含有银,可能含有铜和镁 | |
| C. | 滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜 | |
| D. | 滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀Ca2++HCO3ˉ+OHˉ=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32ˉ+CO2+H2O=2HCO3ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com