
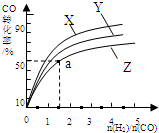
 研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.| 3 |
| 2 |
| n(CH3OH) |
| n(CO2) |
| 温 度 | 300℃ | 400℃ | 500℃ |
| n(甲醇)/mol | 0.21 | 0.17 | 0.11 |
| n(H2) |
| n(CO) |
| 3 |
| 2 |
| 3 |
| 2 |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.5×0.5 |
| 6.4g |
| 32g/mol |


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题: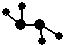 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com