
X是一种重要的工业原料, X在160℃分解制备异氰酸和氨气,反应方程式为:X  HCNO + NH3(已配平)。完成下列填空:
HCNO + NH3(已配平)。完成下列填空:
(1)在上述反应所涉及的各元素中,原子半径最大的元素是_________,其原子核外电子共占据_______个轨道。
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素C,N,O非金属性递变规律的事实是____________。
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=__________mol/L·min。
(4)当该反应达到平衡时,下列说法一定错误的是___________。
a.气体密度不变 b.气体颜色不变
c.υ(NO)正= 2υ(N2)逆 d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如图所示,X电子式为______________。

(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出氰酸和异氰酸的结构式:_______________、______________。
(1)C(1分),4个(1分)
(2)c(2分)
(3)0.005mol/(L·min) (2分)
(4)c(2分)
(5)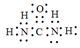 (2分)
(2分)
(6)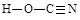
 (2分)
(2分)
【解析】
试题分析:根据X  HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
(1)各元素中,原子半径最大的元素是碳,其原子核外电子共占据4个轨道分别是1S22S22P2,其中S轨道2个,P轨道2个。
(2)元素非金属性递变规律的事实可能通过c.两两形成化合物中元素的化合价来判断,由于氧元素没最高价氧化物对应水化物,故也无法通过单质与H2反应的难易程度来判断。正确答案为bc。2NH3(g)+NO(g)+NO2(g)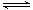 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=0.4/(2*20)*2=_0.005mol/(L·min) 。
(4)a.气体密度始终不变,不能做为判断依据。b.气体颜色不变即浓度不变,正确。c.υ(NO)正= 2υ(N2)逆比值关系错误,错误。d.N2和NH3的浓度相等不一定平衡,正确。故选C。
(5)X电子式为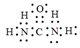 。
。
(6)根据信息氰酸和异氰酸的结构式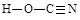
 。
。
考点:本题考查原子半径,元素非金属性,化学反应速率计算及结构式的书写。


科目:高中化学 来源: 题型:
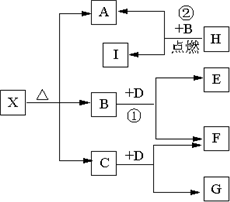
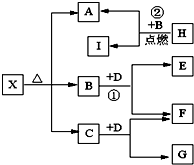 已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.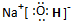
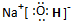
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
 2MgO+C
2MgO+C 2MgO+C
2MgO+C查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料。它们有如图所示的转化关系。
试回答下列问题
(1)X的化学式为: ;G的电子式为 。
(2)写出下列反应的化学方程式
① ② 。
(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为 ,电解质溶液为 。
(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H 克,有关化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011届宁夏银川一中高三第一次模拟考试(理综)化学部分 题型:填空题
(14分)
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料。它们有如图所示的转化关系。
试回答下列问题
(1)X的化学式为: ;G的电子式为 。
(2)写出下列反应的化学方程式
① ② 。
(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为 ,电解质溶液为 。
(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H 克,有关化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com