
| 酸 | 电离常数Ka |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| CH3COOH | Ka=1.8×10-5 |
| HClO | Ka=3.0×10-8 |
| A、pH相同的Na2CO3、CH3COONa、NaClO各加水稀释相同倍数,pH变化最小的是Na2CO3 |
| B、表中所列的三种酸的溶液中滴入石蕊试剂,溶液一定都变红 |
| C、次氯酸钠溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO |
| D、常温下,在0.1mol/L的CH3COOH溶液中滴加0.1mol/L的NaOH溶液发生反应,当c(H+)=1.8×10-5时,溶液中下列微粒的浓度大小关系为:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
| c(CH3COO-).c(H+) |
| c(CH3COOH) |
| c(CH3COO-).c(H+) |
| c(CH3COOH) |
| c(CH3COO-)×1.8×10-5 |
| c(CH3COOH) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2的相对分子质量为44g/mol |
| B、“物质的量”是“物质的质量”的简称 |
| C、摩尔只能用于计量纯净物 |
| D、阿伏伽德罗常数的单位是mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
| △ |
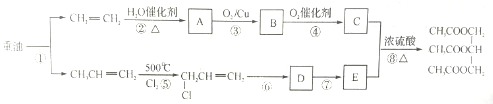
查看答案和解析>>
科目:高中化学 来源: 题型:
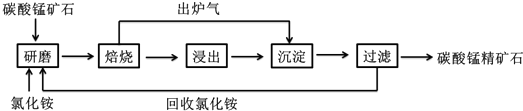
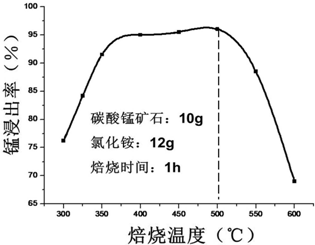
查看答案和解析>>
科目:高中化学 来源: 题型:
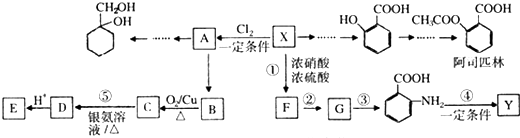
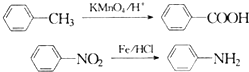 (苯胺,易被氧化)
(苯胺,易被氧化)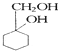 的流程图:
的流程图: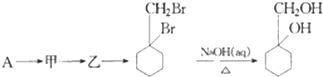
 多一个碳原子的同系物M有多种同分异构体,同时符合下列4个条件的M同分异构体有
多一个碳原子的同系物M有多种同分异构体,同时符合下列4个条件的M同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
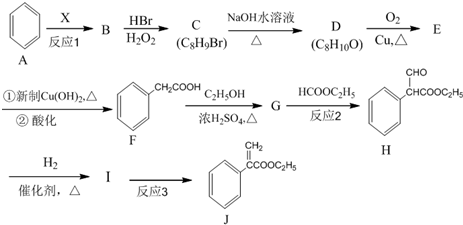
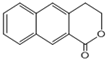 是一种重要的药物合成中间体,请结合题目所给信息,写出以
是一种重要的药物合成中间体,请结合题目所给信息,写出以 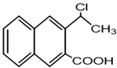 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、⑤ | C、②③④ | D、④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com