
A、2SO2+O2
| ||||
| B、SO2+2H2S═3S↓+2H2O | ||||
| C、SO2+NaOH═NaHSO3 | ||||
| D、SO2+Cl2+H2O═H2SO4+2HCl |
科目:高中化学 来源: 题型:
| A、达平衡时,SO2的消耗速率必定等于O2的生成速率的2倍 |
| B、达平衡时,升高温度,逆反应速率增加,正反应速率减小 |
| C、达平衡后,若保持压强不变,充入少量氖气,则平衡向左移 |
| D、达平衡后,若保持体积不变,充入少量O2气体,则平衡向右移,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属氧化物一定不是碱性氧化物 |
| B、HCl、H2S、NH3都是电解质 |
| C、漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离 |
| D、Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为56,中子数为30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 | ||||||||
| 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
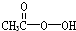 )是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应:
)是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应: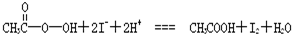
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学家可以制造出自然界中不存在的物质 |
| B、化学研究的主要目的就是认识分子 |
| C、化学科学与其他科学分支的联系不密切 |
| D、化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com