
【题目】下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
【答案】C
【解析】A项,氧化还原反应不一定属于四大基本反应类型,如反应2Na2O2+2H2O=4NaOH+O2↑属于氧化还原反应,但不属于四大基本反应类型,错误;B项,氧化还原反应中有的物质参与反应既不是氧化剂又不是还原剂,如反应2Na2O2+2H2O=4NaOH+O2↑中H2O既不是氧化剂又不是还原剂,错误;C项,在氧化还原反应中氧化剂和还原剂可以是不同物质(如Zn+2HCl=ZnCl2+H2↑等),也可以是同种物质(如2KMnO4![]() K2MnO4+MnO2+O2↑等),正确;D项,氧化性(或还原性)的强弱指得(或失)电子的能力,与得(或失)电子的多少无关(如还原性:Na
K2MnO4+MnO2+O2↑等),正确;D项,氧化性(或还原性)的强弱指得(或失)电子的能力,与得(或失)电子的多少无关(如还原性:Na![]() Al,Na失去1个电子,Al失去3个电子等),得电子能力越强氧化性越强,失电子能力越强还原性越强,错误;答案选C。
Al,Na失去1个电子,Al失去3个电子等),得电子能力越强氧化性越强,失电子能力越强还原性越强,错误;答案选C。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生22.4L气体
C. 若实验室需要4.6mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.10 mol/L、体积均为![]() 的HA和HB溶液,分别加水稀释至体积V,PH随
的HA和HB溶液,分别加水稀释至体积V,PH随![]() 的变化如图所示,下列叙述正确的是( )
的变化如图所示,下列叙述正确的是( )

A. 该温度下HB的电离平衡常数约等于1.11×10-5
B. 当![]() =3时,若两溶液同时升高温度,则c(B)/c(A)减小
=3时,若两溶液同时升高温度,则c(B)/c(A)减小
C. 相同条件下NaA溶液的pH大于NaB溶液的pH
D. 溶液中水的电离程度:a = c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质发生反应:①Na和O2 ②AlCl3与氨水 ③水玻璃与CO2 ④Fe与Cl2 ⑤Fe和稀HNO3 ,因反应物用量或反应条件的不同而生成不同产物的是
A.①②③④⑤ B.①②③⑤ C.①②⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
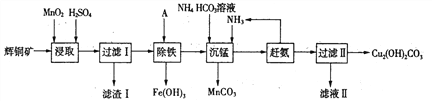
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
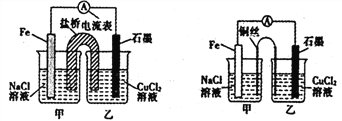
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A. B为短周期元素,两元素可形成化合物AB2,已知其原子序数分别为a和b,则a不可能为( )
A. b+4 B. b-5 C. b+6 D. b+8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
![]()
化学位移5
下列关于该有机物的叙述正确的是
A. 该有机物属于芳香族化合物
B. 键线式中的Et代表的基团为-CH3
C. 该有机物不同化学环境的氢原子有8种
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com