
 CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
 CO2(g) + 3H2(g) ;△H>0(1)根据阿伏加德罗定律:等温等容条件下,气体的压强之比等于气体的物质的量之比,分析题意知,反应前气体的总物质的量为4mol,20s后,测得混合气体的压强是反应前的1.2倍,则混合气体的物质的量为4.8mol,增加0.8mol,结合反应方程式CH3OH(g) + H2O(g)
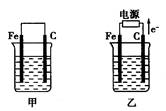
CO2(g) + 3H2(g) ;△H>0(1)根据阿伏加德罗定律:等温等容条件下,气体的压强之比等于气体的物质的量之比,分析题意知,反应前气体的总物质的量为4mol,20s后,测得混合气体的压强是反应前的1.2倍,则混合气体的物质的量为4.8mol,增加0.8mol,结合反应方程式CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) 利用差量法计算,参加反应甲醇的物质的量为0.4mol,根据v=△n/V△t计算,用甲醇表示该反应的速率为0.01mol/(L·s);(2)①v正(CH3OH) = 3v逆(H2),不符合v正 = v逆,错误;②根据密度的定义式判断,混合气体的密度不随反应的进行而变化,为恒量,不能作为平衡标志,错误;③根据摩尔质量的定义判断,混合气体的平均相对分子质量随反应的进行不断变化,当其不变时已达平衡,正确;④CH3OH、H2O、CO2、H2的浓度都不再发生变化,正确;⑤平衡时CO2和H2的浓度之比不一定为1:3,错误,选③④ ;(3)根据题给装置图判断,B容器维持温度和压强不变,根据阿伏加德罗定律:等温等压下气体的体积之比等于气体的物质的量之比, 已知起始时容器B的体积为aL,反应达到平衡时容器B的体积为1.5aL,反应前容器B中气体的总物质的量为3.6mol,则平衡后混合气体的物质的量为5.4mol,气体物质的量增加1.8mol,结合题给方程式利用差量法计算参加反应CH3OH的物质的量为0.9mol,转化率为75%;维持其他条件不变,若打开K一段时间后,相当于2.2molCH3OH(g) 和4.4molH2O(g)反应在等温等压条件下进行,重新达到平衡,根据等效平衡知识判断,气体的总体积为2.75aL,则容器B的体积为1.75aL;Ⅲ.(1)①甲池为原电池,石墨棒作正极,电极反应式为Cu2++2e- = Cu;②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则电解生成0.01mol铜和0.005mol氧气,根据电极反应式
CO2(g) + 3H2(g) 利用差量法计算,参加反应甲醇的物质的量为0.4mol,根据v=△n/V△t计算,用甲醇表示该反应的速率为0.01mol/(L·s);(2)①v正(CH3OH) = 3v逆(H2),不符合v正 = v逆,错误;②根据密度的定义式判断,混合气体的密度不随反应的进行而变化,为恒量,不能作为平衡标志,错误;③根据摩尔质量的定义判断,混合气体的平均相对分子质量随反应的进行不断变化,当其不变时已达平衡,正确;④CH3OH、H2O、CO2、H2的浓度都不再发生变化,正确;⑤平衡时CO2和H2的浓度之比不一定为1:3,错误,选③④ ;(3)根据题给装置图判断,B容器维持温度和压强不变,根据阿伏加德罗定律:等温等压下气体的体积之比等于气体的物质的量之比, 已知起始时容器B的体积为aL,反应达到平衡时容器B的体积为1.5aL,反应前容器B中气体的总物质的量为3.6mol,则平衡后混合气体的物质的量为5.4mol,气体物质的量增加1.8mol,结合题给方程式利用差量法计算参加反应CH3OH的物质的量为0.9mol,转化率为75%;维持其他条件不变,若打开K一段时间后,相当于2.2molCH3OH(g) 和4.4molH2O(g)反应在等温等压条件下进行,重新达到平衡,根据等效平衡知识判断,气体的总体积为2.75aL,则容器B的体积为1.75aL;Ⅲ.(1)①甲池为原电池,石墨棒作正极,电极反应式为Cu2++2e- = Cu;②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则电解生成0.01mol铜和0.005mol氧气,根据电极反应式

 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:不详 题型:填空题
 =
= mol
mol
 =
=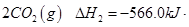 mol
mol
 =
= mol
mol

 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数( )的大小关系为 ;
)的大小关系为 ;
 和2 mol
和2 mol  通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 |
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1 NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1 |
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 |
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1 NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1+Q2+Q3 | B.1.5Q1-0.5Q2+0.5Q3 |
| C.0.5Q1-1.5Q2+0.5Q3 | D.0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1 O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
 Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) ΔH1="-393.5" kJ/mol;
CO2(g) ΔH1="-393.5" kJ/mol; O2(g)
O2(g) H2O(g) ΔH2="-241.8" kJ/mol;
H2O(g) ΔH2="-241.8" kJ/mol; O2(g)
O2(g) CO2(g) ΔH3="-283.0" kJ/mol;
CO2(g) ΔH3="-283.0" kJ/mol; CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。  CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol H+(aq)+OH-(aq) △H=b kJ/mol
H+(aq)+OH-(aq) △H=b kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com