
钛(Ti)被誉为“21世纪的金属”.工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti.其反应如下:
①TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为________.
(2)与CO互为等电子体的分子是________.
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.
①TiCl4为________化合物(填“离子”或“共价”).
②TiCl4分子为正四面体形,则Ti为________杂化.
③TiCl4在潮湿空气中水解的化学方程式是________.
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是________(填操作名称).
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为________,中心离子配位数为________.
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
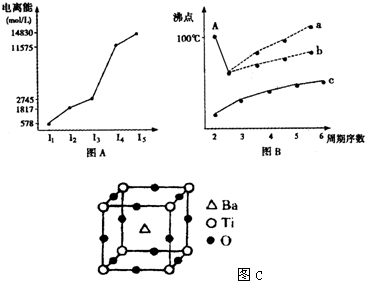 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第| 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省皖北协作区髙三年级联考化学试卷(解析版) 题型:实验题
钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过程如下:
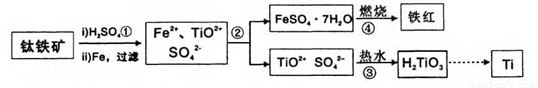
已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、 (填操作名称);步骤④在实验室中常将试剂置于 (填仪器名称)中加强热。
(2)步骤③中加入热水的作用是 。
(3)步骤④中硫酸亚铁晶体(FeSO4·7H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式: 。
(4)步骤②所得到的硫酸亚铁晶体(FeSO4·7H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeO·FeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO4·7H2O的质量应为废水中六价铬(相当于CrO3)质量的 倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com