
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4可作为火箭推进剂的主要原因为______________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是___________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是___________。
【答案】(1)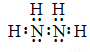 -2
-2
(2)NaClO+2NH3=N2H4+NaCl+H2O
(3)2ΔH 3-2ΔH 2-ΔH 1 反应放热量大、产生大量气体
(4)8.7×10-7 N2H6(HSO4)2
(5)固体逐渐变黑,并有气泡产生 1 N2H4的用量少,不产生其他杂质(还原产物为N2和H2O,而Na2SO3产生Na2SO4)
【解析】(1)联氨是由两种非金属元素形成的共价化合物,电子式为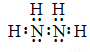 ,根据化合价代数和为零,其中氮的化合价为-2。
,根据化合价代数和为零,其中氮的化合价为-2。
(2)次氯酸钠溶液与氨反应制备联氨,Cl元素的化合价由+1价降低到-1价,N元素的化合价由-3价升高到-2价,根据得失电子守恒和原子守恒配平,反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O。
(3)根据盖斯定律,反应热效应之间的关系式为ΔH 4=2ΔH 3-2ΔH 2-ΔH 1。联胺有强还原性,N2O4有强氧化性,两者在一起易发生自发地氧化还原反应,反应放热量大、产生大量气体,所以联氨和N2O4可作为火箭推进剂。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2O![]() N2H5++OH-,已知:N2H4+H+
N2H5++OH-,已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 ;联氨为二元弱碱,酸碱发生中和反应生成盐,则联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2 。
N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 ;联氨为二元弱碱,酸碱发生中和反应生成盐,则联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2 。
(5)联氨是一种常用的还原剂,AgBr具有氧化性,两者发生氧化还原反应生成银,则向装有少量AgBr的试管中加入联氨溶液,可观察到固体逐渐变黑,并有气泡产生;联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,发生的反应为N2H4+O2=N2+2H2O,理论上1 kg的联氨可除去水中溶解的氧气为1 kg÷32 g/mol×32 g/moL=1 kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是N2H4的用量少,不产生其他杂质,而Na2SO3的氧化产物为Na2SO4。


科目:高中化学 来源: 题型:
【题目】某精细化工厂,将棉花加工成很细的颗粒结构,然后把它添加到食品中去,可改变食品的口感,使食品易加工成型,降低人体获得的热量等,这是因为纤维素
A. 是人体重要营养物质
B. 在人体中可水解成葡萄糖
C. 不能被所有动物吸收
D. 不能被人体吸收,但可促进消化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH为正四面体结构,可推测PH 也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是( )
A.Fe3O4俗称铁红,常做红色油漆和涂料
B.燃料电池的燃料都在负极发生氧化反应
C.“歼﹣20”飞机上使用的碳纤维是一种新型的有机高分子材料
D.工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
A. 离子半径:Ca2+>Cl->S2-
B. 第一电离能:Si>C>N
C. 电负性:F>S>Mg
D. 热稳定性:SiH4>H2S>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,xg甲气体和yg乙气体占有相同的体积,根据阿伏加德罗定律判断下列叙述错误的是( )
A.x∶y等于甲与乙的相对分子质量之比
B.x∶y等于甲与乙的分子个数之比
C.x∶y等于同温同压下甲与乙的密度之比
D.y∶x等于同温同体积下,等质量的甲与乙的压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处处留心皆知识.生活中遇到下列问题,不涉及到化学变化的是( )
A.食物腐败变质
B.浓硫酸在空气中体积增大
C.铝表面形成致密的薄膜
D.食醋洗掉水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】救灾物资中的一瓶“84消毒液”的包装说明上有如下信息:
含25%NaClO(次氯酸钠)、1 000 mL、密度1.19 g/cm3,稀释100倍(体积比)后使用。
请回答下列问题:
(1)上述“84消毒液”的物质的量浓度为________mol/L。
(2)该同学取100 mL上述“84消毒液”,稀释后用于消毒,稀释100倍后的溶液中
c(Na+)=________mol/L(假设稀释后溶液密度为1.0 g/cm3),该消毒液长时间放置在空气中能吸收标准状况下CO2的体积为________L。
(3)灾区志愿者根据上述“84消毒液”的包装说明,欲用NaClO固体(NaClO易吸收空气中的H2O、CO2)配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
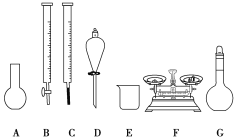
a.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
b.容量瓶用蒸馏水洗净后,要烘干才能用于溶液的配制
c.利用购买的商品NaClO来配制可能会导致结果偏低
d.需要NaClO固体的质量为143 g
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- b mg/L,现用ClO2将CN-氧化,只生成两种无毒气体,其离子反应方程式为________,处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置:
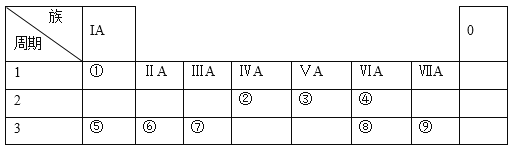
回答下列问题:
(1)写出②,③,④的气态氢化物的稳定性强弱_______________________;
(2)⑤-⑨的简单离子半径由大到小的顺序为:_______________________;(填离子符号)
(3)用电子式表示②的最高价氧化物的形成过程:____________;
(4)请设计实验比较元素⑥与⑦金属性的相对强弱:_________________;
(5) X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为_________,写出X溶液与小苏打反应的离子方程式为___________________。
(6)用由①、②两种元素组成的空间构型为正四面体结构的有机物A与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入A,乙极通入④的单质,则甲极的电极反应式为:_________________________________,一段时间后KOH的浓度将___(填“变大”、“变小”、“不变”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com