


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
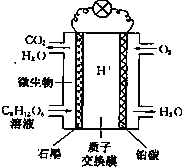 微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体.将有机物的化学能转化为电能.以葡萄糖溶液作底物为例,其工作原理如图所示.
微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体.将有机物的化学能转化为电能.以葡萄糖溶液作底物为例,其工作原理如图所示.| 序号 | A | B | C | D | E |
| 污水类型 | 生活污水 | 印染 | 电镀 | 造纸 | 硫酸工业废水 |
| COD值/mg?L-1 | 520 | 870 | 20 | 960 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl3、CuCl2 | Fe、Cu |
| ② | FeCl2、CuCl2 | Cu |
| ③ | FeCl2 | Cu |
| ④ | FeCl3、CuCl2 | Cu |
| ⑤ | FeCl2、CuCl2 | Fe |
| ⑥ | FeCl2、CuCl2、FeCl3 | 没有固体不溶物 |
| ⑦ | FeCl2 | Fe、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com