
如图:a、b、c、d均为铂电极,供选择的四组电解液如下:
组 A B C D
甲槽 NaOH AgNO3 H2SO4 NaCl
乙槽 CuSO4 CuCl2 AgNO3 AgNO3
要求满足的条件是:
(a)工作一段时间后,甲槽电解液pH值上升,乙槽电解液的pH值下降
(b)a、d两极放电离子的物质的量相等
请填写下列空格:
(1)应选用的电解液是哪一组D;(填字母)
(2)甲槽的电解方程式 .
(3)当a极析出3.55g电解产物时,d极上将析出 g物质.

考点: 电解原理.
分析: ①工作一段时间后甲槽pH值上升,乙槽的pH下降.②b、c两极上反应的离子的物质的量相等.惰性电极电解;
A、甲槽是电解水,氢氧化钠溶液PH增大,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解硫酸铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e﹣=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等;
B、甲槽是电解硝酸银,溶液PH减小,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解氯化铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e﹣=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等;
C、甲槽是电解水,硫酸溶液PH减小,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e﹣=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等;
D、甲槽是电解氯化钾,氯化钾溶液PH增大,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e﹣=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等,以此解答.
解答: 解:(1)A、甲槽是电解水,氢氧化钠溶液PH增大,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解硫酸铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e﹣=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等,故A不符合;
B、甲槽是电解硝酸银,溶液PH减小,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解氯化铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e﹣=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等,故B不符合;
C、甲槽是电解水,硫酸溶液PH减小,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e﹣=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等.故C不符合;
D、甲槽是电解氯化钠,氯化钾溶液PH增大,b电极是阳极,电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑;乙槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e﹣=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等,故D符合;
故选D;
(2)甲槽是电解水,电解方程式:2H20 2H2↑+O2↑,故答案为:2H20
2H2↑+O2↑,故答案为:2H20 2H2↑+O2↑;
2H2↑+O2↑;
(3)当a极析出3.55g电解产物时,根据电极反应:Ag++e﹣=Ag,则a极上转移电子是: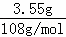 ≈0.033mol,d极上4OH﹣﹣4e﹣=2H2O+O2↑,析出氧气质量:
≈0.033mol,d极上4OH﹣﹣4e﹣=2H2O+O2↑,析出氧气质量: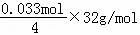 =0.264g,故答案为:0.264.
=0.264g,故答案为:0.264.
点评: 本题考查了电解原理的应用,电子守恒的计算应用,电极反应、电极判断、电极名称分析是解题关键,题目难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
如图是关于反应A2(g)+3B2(g)⇌2C(g)△H<0的平衡移动图形,影响平衡移动的原因是()
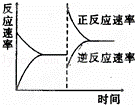
A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时减小生成物浓度
D. 增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钠能与水剧烈反应:2Na+2H2O=2NaOH+H2↑
(1)相同质量的Na,Mg,Al与过量的盐酸反应,在相同的状况下,三者置换出的H2的体积比是 .
(2)相同物质的量的Na,Mg,Al与过量的盐酸反应,在相同状况下,三者置换出的H2的体积比是 .
(3)Na,Mg,Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,则Na,Mg,Al三种金属的物质的量之比是.
(4)将Na,Mg,Al各0.3mol分别投入到含0.1mol HCl的盐酸中,同温同压下产生气体的体积比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是()
A. KOH(aq)+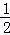 H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
B. 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=﹣114.6kJ/mol
C. 2KOH(aq)+H2SO4=K2SO4(aq)+H2O (l);△H=+114.6kJ/mol
D. KOH (aq)+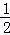 H2SO4(aq)=
H2SO4(aq)=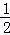 K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为()
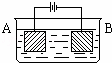
A. 4:1 B. 3:1 C. 2:1 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示的一些物质或概念间的从属关系中不正确的是( )
| X | Y | Z | |
| A | 碱 | 化合物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 混合体系 |
| D | 活泼金属氧化物 | 电解质 | 化合物 |
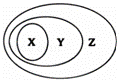
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在下面的化学式上标出电子转移的方向和数目KMnO4+KI+H2SO4→
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组.原因是 . .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验处理不可行的是( )
①将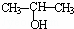 与NaOH的醇溶液共热制备CH3﹣CH═CH2
与NaOH的醇溶液共热制备CH3﹣CH═CH2
②向甲酸(H﹣COOH)和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛
③向丙烯醛(CH2=CH﹣CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象.
|
| A. | 只有①③ | B. | 只有①②④ | C. | 只有②③④ | D. | 都不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com