
 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
分析 (1)书写反应的平衡常数表达式计算得到平衡常数关系;
(2)依据化学平衡三段式列式计算,再根据v=$\frac{△c}{△t}$进行计算;转化率=$\frac{消耗量}{起始量}×100%$;
(3)①一氧化碳量的增加,平衡正向进行,二氧化硫的转化率增大;
②反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小.
解答 解:(1)I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
依据盖斯定律计算$\frac{I+Ⅱ}{2}$得反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g),
K1=$\frac{c(C{O}_{2})c(S{O}_{2})}{c(CO)}$,K2=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$,K=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)}$,
计算得到:K3=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$,
故答案为:$({K}_{1}•{K}_{2})^{\frac{1}{2}}$;
(2)CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)
起始量(mol/L) 3 0 0
变化量(mol/L) 1.8 1.8 1.8
20s量(mol/L) 1.2 1.8 1.8
前20s内v(SO2)=$\frac{1.8mol/L}{20s}$=0.09mol/L•s;
30s达到平衡状态,平衡时CO的转化率=$\frac{3mol/L-0.9mol/L}{3mol/L}$×100%=70%;
故答案为:0.09,70%;
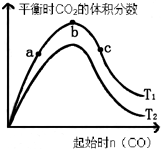
(3))①依据图象分析,随一氧化碳量的增加,二氧化硫的转化率增大,c点最大;
故答案为:c;
②依据平衡移动原理,反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1,
故答案为:高于;反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
点评 本题考查了盖斯定律的应用、化学反应速率、转化率和平衡常数的计算,题目难度中等.


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(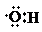 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
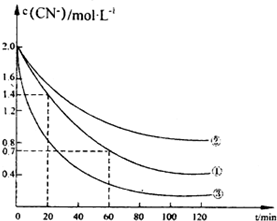 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.5:108 | B. | 1:8 | C. | 108:35.5 | D. | 137:71 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CH2Br | B. | CH2═CH-CH2-CH2-CH2Cl | ||
| C. | CH3Cl | D. | CH2═CH-CH2-C(CH3)2CH2Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com