
【题目】(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_________(填选项序号)。
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7molL﹣1,c(Zn2+)=0.1molL﹣1,c(Cl﹣)=0.3molL﹣1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_________。
(4)0.3mol的甲烷与_________g氨气中所含氢原子数相等。
(5)在同温同压下,2g二氧化碳的体积为120ml,而2gA气体的体积为165ml,则气体A的摩尔质量_________________;
(6)标准状况下,11.2L二氧化碳和一氧化碳混合气体的质量为18g,则其中二氧化碳的质量为_________,一氧化碳的体积为_________。
(7)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100molL﹣1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl﹣,则S2O32﹣将转化成____________。
A.S2﹣ B.S C.SO32﹣ D.SO42﹣
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7+14HCl(浓)=3Cl2↑+2CrCl3+2KCl+7H2O,若反应中转移0.6mole﹣,则被氧化的HCl的物质的量为_____________。
【答案】A 2.8g 0.03mol 6.8 32g/mol 11g 5.6L D 0.6mol
【解析】
(1)等质量的CH4、CO2、O2、SO2四种气体的物质的量与其摩尔质量成反比,即摩尔质量越大,则物质的量越小,在同温同压下,体积越小,据此进行解答;
(2)在标准状况下,2.24L由N2、N2O组成的混合气体物质的量n=V/Vm,据m=nM来计算质量即可;
(3)根据溶液中各种离子遵循电荷守恒来回答判断;
(4)根据0.3mol的甲烷含有氢原子物质的量计算氨气的物质的量,根据m=nM计算氨气的质量;
(5)结合n=![]() =
=![]() 计算;
计算;
(6)根据n=![]() 进行相关物理量的计算,可设CO为xmol,CO2为ymol,列方程式计算。
进行相关物理量的计算,可设CO为xmol,CO2为ymol,列方程式计算。
(7)①在氧化还原反应中,化合价降低总数=化合价升高总数=转移电子数,根据转移电子相等确定生成物;
②反应的化学方程式为K2Cr2O7+14HCl(浓)=3Cl2↑+2CrCl3+2KCl+7H2O,若反应中转移6mole-,则被氧化的HCl的物质的量是6mol,据此回答。
(1)气体的物质的量n=![]() ,在同温同压下,气体摩尔体积相同,气体的体积V=nVm,即V=
,在同温同压下,气体摩尔体积相同,气体的体积V=nVm,即V=![]() Vm可知,摩尔质量越大,体积越小;CH4、CO2、O2、SO2的摩尔质量分别为16g/mol、44g/mol、32g/mol、64g/mol,SO2的摩尔质量最大,故体积最小,故A正确,故答案为A;
Vm可知,摩尔质量越大,体积越小;CH4、CO2、O2、SO2的摩尔质量分别为16g/mol、44g/mol、32g/mol、64g/mol,SO2的摩尔质量最大,故体积最小,故A正确,故答案为A;
(2)在标准状况下,2.24L由N2、N2O组成的混合气体物质的量n=V/Vm=0.1mol,据m=nM=0.1mol×2×14g/mol=2.8g;
(3)溶液中各种离子遵循电荷守恒,2c(SO42- )+c(Cl-)=2c(Zn2+)+c(K+),解得2c(SO42- )=0.1×2+0.7-0.3=0.6mol/L,c(SO42- )=0.3mol/L,则n(SO42- )=0.3mol/L×0.1L=0.03mol,加入氯化钡产生硫酸钡的物质的量为0.03mol;
(4)与0.3molCH4分子中所含氢原子数相等的氨气物质的量=![]() =0.4mol,故氨气的质量=0.4mol×17gmol-1=6.8g;
=0.4mol,故氨气的质量=0.4mol×17gmol-1=6.8g;
(5)n(CO2)=![]() =
=![]() mol,Vm=
mol,Vm=![]() =
= =2.64L/mol,则n(A)=
=2.64L/mol,则n(A)=![]() =0.0625mol,M(A)=
=0.0625mol,M(A)=![]() =32g/mol;
=32g/mol;
(6)气体的物质的量为n=![]() =
=![]() =0.5mol,设CO为xmol,CO2为ymol,则:28x+44y=18、x+y=0.5,解得:x=0.25、y=0.25;故m(CO2)=0.25mol×44g/mol=11g,n(CO)=0.25mol,V(CO)=0.25mol×22.4L/mol=5.6L;
=0.5mol,设CO为xmol,CO2为ymol,则:28x+44y=18、x+y=0.5,解得:x=0.25、y=0.25;故m(CO2)=0.25mol×44g/mol=11g,n(CO)=0.25mol,V(CO)=0.25mol×22.4L/mol=5.6L;
(4)①n(Na2S2O3)=0.1mol/L×0.025L=0.0025mol,氯气的物质的量=0.01mol,二者完全反应时转移电子相等,设硫代硫酸根离子被氧化后硫元素的化合价为x,
0.01mol×2×(1-0)=0.0025mol×2×(x-2),4=x-2,x=+6,所以硫代硫酸根离子转化为硫酸根离子,故答案为:D;
②反应的化学方程式为K2Cr2O7+14HCl(浓)=3Cl2↑+2CrCl3+2KCl+7H2O,若反应中转移6mole-,则被氧化的HCl的物质的量是6mol,若反应中转移0.6mole-,则被氧化的HCl的物质的量是0.6mol。


科目:高中化学 来源: 题型:
【题目】维生素C又称抗坏血酸,能增强对传染病的抵抗力,有解毒作用等,其结构式为 ,下列有关说法错误的是
,下列有关说法错误的是
A.维生素C分子式为C6H8O6
B.维生素C的同分异构体中可能有芳香族化合物
C.向维生素C溶液中滴加紫色石蕊试液,溶液颜色变红,说明维生素C溶液显酸性
D.在一定条件下,维生素C能发生氧化反应、加成反应、取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH_________0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时υ正_____υ逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO(g)的浓度(mol·L-1)分别为0.2、0.1则:
①平衡时H2的转化率为________(保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3分解的热化学方程式为![]() .在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
.在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
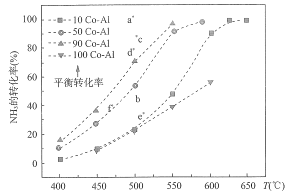
下列说法错误的是
A.活化能最小的催化剂是 90 Co-A1
B.如果增大气体流速,则b点对应的点可能为e
C.温度为T时,向体积为1L的恒容容器中加入0.8 molNH3和0.1molH2,达到平衡时,NH3的转化率为75%,则平衡常数为K=7.5
D.在两个体积均为VL的绝热密闭容器中分别投入①2 mol NH3,②3 mol H2和1mol N2,达到平衡时,NH3的体积分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
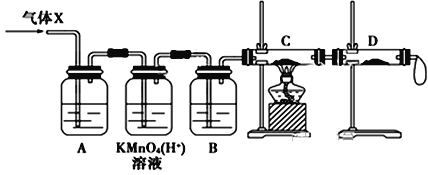
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
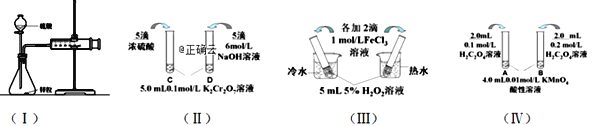
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项):______________________。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
(3)实验(Ⅲ)中实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,中药血必净注射液对冠状病毒导致的炎症反应有抑制作用,其主要成分为红花等中药材提取物。红花中含有的一种物质结构如图,下列有关该物质的说法不正确的是
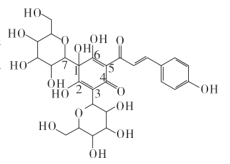
A.其分子式为C27H32O16B.其分子中含有5种官能团
C.能发生酯化反应和加成反应D.其分子中1~7号碳原子不在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是( )
![]()
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com