
【题目】下列属于吸热反应的是
A. 甲烷燃烧B. 生石灰与水反应
C. 石灰石高温分解D. 锌粒与稀硫酸反应
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C ![]() 2AlN+3CO合成.下列叙述正确的是( )
2AlN+3CO合成.下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示个各物质间的转化关系中,X、Y、Z包含相同的元素 
(1)气体Z是色,具有气味的气体.
(2)固体X溶于水(填“能”或“不”)
(3)请写出Z与O2生成Y的化学方程式 .
(4)请写出X与浓硫酸反应生成Y的化学方程式 .
(5)请写出Z与Y反应生成X的化学方程式 .
(6)将Y通入到溴水当中发现溴水褪色,请写出其离子方程式 , 这体现了Y具有性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体(CuSO45H2O). 
请回答:
(1)写出步骤Ⅱ反应的离子方程式: .
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪有 .
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是 .
(4)从溶液E得到绿矾晶体的实验操作是、过滤.
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:写出途径③中反应的化学方程式: , 用途径 ①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的理解错误的是( )
A.电子式 ![]() 可以表示甲基,但不能表示CH3+
可以表示甲基,但不能表示CH3+
B.比例模型 ![]() 既能表示甲烷分子,也能表示四氯化碳分子
既能表示甲烷分子,也能表示四氯化碳分子
C.C2H4O2可以表示乙酸、甲酸甲酯等物质
D.离子结构示意图 ![]() 可以表示32S2﹣ , 也可以表示34S2﹣
可以表示32S2﹣ , 也可以表示34S2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中,溶质X,Y的浓度都为0.1molL﹣1 , 向混合溶液中滴加某溶液Z(0.1molL﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X,Y,Z分别是( ) 
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
A.H2O2 B.KMnO4 C.KOH D.SO2
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.请回答下列问题: 
(1)B物质中官能团的名称;
(2)写出反应②的化学方程式(及反应类型): .
(3)写出C与银氨溶液反应的化学方程式: .
(4)写出乙酸乙酯在碱性条件下水解的化学方程式(及反应类型): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)工业制漂白粉的化学方程式为 .
(2)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有性.
(3)工业上在80℃时电解氯化钠溶液得到 NaClO3 , 然后与盐酸反应得到ClO2 . 电解时生成ClO3﹣的电极反应式为 .
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32﹣+I2═S4O62﹣+2I﹣)
Ⅲ.加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示: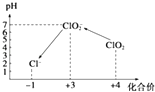
请回答:
①操作Ⅰ中反应的离子方程式是 .
②确定操作Ⅱ完全反应的现象是 .
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 .
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10﹣3 mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是mg/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com