

| A. | A气体是NH3 | |
| B. | 悬浊液的离子主要有Na+、NH4+、Cl-、HCO3- | |
| C. | 第Ⅲ步操为过滤 | |
| D. | 第Ⅳ步操作所使用的仪器主要有铁架台、酒精灯、蒸发皿、玻璃棒 |
分析 碱性溶液中利用二氧化碳的吸收,则A为NH3,与NaCl、B发生NH3•H2O+CO2+NaCl═NH4Cl+NaHCO3↓,气体B为CO2,过滤后得到NaHCO3,NaHCO3加热分解可制备纯碱,以此来解答.
解答 解:碱性溶液中利用二氧化碳的吸收,则A为NH3,与NaCl、B发生NH3•H2O+CO2+NaCl═NH4Cl+NaHCO3↓,气体B为CO2,过滤后得到NaHCO3,NaHCO3加热分解可制备纯碱,
A.由上述分析可知,A气体是NH3,故A正确;
B.II中发生NH3•H2O+CO2+NaCl═NH4Cl+NaHCO3↓,悬浊液的离子主要有Na+、NH4+、Cl-、HCO3-,故B正确;
C.由上述分析可知,第Ⅲ步操为过滤,故C正确;
D.第Ⅳ步操作为加热碳酸氢钠固体,所使用的仪器主要有铁架台、酒精灯、试管,故D错误;
故选D.
点评 本题考查物质的制备实验,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,注意蒸发皿用于可溶性固体与液体的分离,侧重分析与实验能力的考查,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 氨碱法 | 联合制碱法 | ||
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D. | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
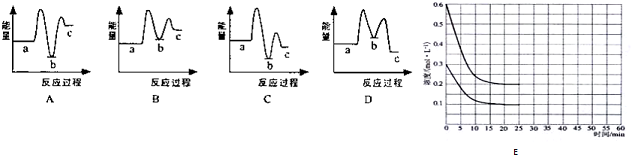
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com