
| A. | 回收废旧电池的首要原因是回收石墨 | |
| B. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| C. | 焚烧一次性饭盒可减少白色污染 | |
| D. | 燃煤时加适量的生石灰可减少二氧化硫的排放 |
分析 A.废旧电池含有大量重金属汞和镉;
B.酸雨的pH小于5.6;
C.焚烧一次性饭盒可生成致癌性物质;
D.燃煤时生成二氧化硫,二氧化硫导致酸雨的发生,加CaO与二氧化硫反应.
解答 解:A.废旧电池含有大量重金属汞和镉,随意丢弃容易造成环境污染,应回收处理,而不是回收石墨,故A错误;
B.酸雨的pH<5.6,正常雨水的pH约为5.6,故B错误;
C.焚烧一次性饭盒可生成致癌性物质,不能焚烧,应使用聚乳酸代替塑料的使用,减少白色污染,故C错误;
D.燃煤时生成二氧化硫,二氧化硫导致酸雨的发生,加CaO与二氧化硫反应,可减少二氧化硫的排放,故D正确.
故选D.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境保护、尾气处理为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | D与E可形成既含极性键又含非极性键的分子 | |
| B. | B的最高价氧化物为酸性氧化物,不能与任何酸反应 | |
| C. | B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱 | |
| D. | A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
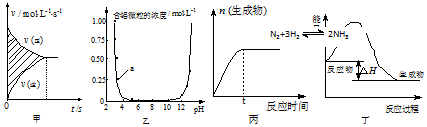
| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
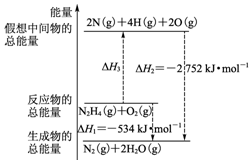 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
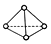 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com