
分析 (1)草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32-];
(2)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变;
(3)①原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
②步骤二中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,测定、KHC2O4的含量增大,草酸含量减小;
③令H2C2O4、KHC2O4的物质的量分别为xmol、ymol,根据①②中计算结果列方程计算,进而计算原样品中各自质量分数;
解答 解:(1)草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32-],
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-),C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)正确,
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-),D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)错误,
故答案为:AC;
(2)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变,
故答案为:当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变;
(3)①原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变,
故答案为:当滴入最后一滴酸性高锰酸钾溶液时,溶液由无色变为浅红色(或紫色、紫红色),且半分钟内不褪色;
②步骤二中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,测定、KHC2O4的含量增大,草酸含量减小,
故答案为:偏小;
③由于实验时所取溶液均为配置时的$\frac{1}{10}$,所以①、②中计算的数据均为配置溶液中溶质的$\frac{1}{10}$,由①得:2n(H2C2O4•2H2O)+n(KHC2O4)=0.05mol,由②得:n(H2C2O4•2H2O)+n(KHC2O4)=0.04mol,由上述两个方程式得:n(H2C2O4•2H2O)=0.01mol,n(KHC2O4)=0.03mol,
故答案为:0.01mol.
点评 本题考查了氧化还原反应的计算及中和滴定的物质的量的计算,学生要注意250ml只取其中的$\frac{1}{10}$为易忽略的地方,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
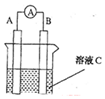 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com