
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:分析 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大;第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A是C元素;C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构,且原子序数大于A而小于C,则B是N元素;
D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D是Cu元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
基态D原子核外有29个电子,根据构造原理书写基态D原子的简化电子排布式;
(2)A的最高价氧化物对应的水化物是H2CO3,该分子中中心原子C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式及碳酸根离子空间构型;
(3)CN-与N2互为等电子体,则每个CN-中含有2个π键,据此计算1mol CN-中含有的π键个数;
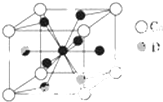
(4)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,利用均摊法计算Ca、Cu原子个数之比;
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,根据Ca、Cu合金确定该镧镍合金中n值;其密度$ρ=\frac{m}{V}$.
解答 解:A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大;第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A是C元素;C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构,且原子序数大于A而小于C,则B是N元素;
D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D是Cu元素,
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O元素第一电离能从小到大顺序是C<O<N;基态D原子核外有29个电子,根据构造原理书写基态Cu原子的简化电子排布式为[Ar]3d104s1,
故答案为:C<O<N;[Ar]3d104s1;
(2)A的最高价氧化物对应的水化物是H2CO3,该分子中中心原子C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式为sp2,碳酸根离子空间构型为平面三角形,
故答案为:sp2;平面三角形;
(3)CN-与N2互为等电子体,则每个CN-中含有2个π键,则1mol CN-中含有的π键个数为2NA,
故答案为:2NA;
(4)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,该晶胞中Ca原子个数=8×$\frac{1}{8}$=1、Cu原子个数=8×$\frac{1}{2}$+1=5,则Ca、Cu原子个数之比为1:5,
故答案为:1:5;
(5)Ca、Cu合金化学式为CaCu5,镧镍合金与上述合金都具有相同类型的晶胞结构XYn,所以该镧镍合金中n=5,该物质密度=$\frac{\frac{M}{{N}_{A}}}{V}$=$\frac{\frac{4.5}{{N}_{A}}}{9.0×1{0}^{-23}}$g/cm3=0.083 g/cm3,
故答案为:5;0.083g/cm3.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布等知识点,侧重考查学生分析计算及空间想象能力,难点是晶胞计算,题目难度中等.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 升高温度活化能降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,它们互为同分异构体 | |
| C. | “地沟油”可通过水解制得肥皂 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
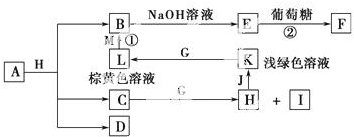
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
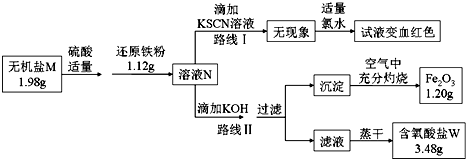
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌作阳极,铁制品作阴极,溶液中含有锌离子 | |
| B. | 锌作阴极,铁制品作阳极,溶液中含有锌离子 | |
| C. | 锌作阳极,铁制品作阴极,溶液中含有亚铁离子 | |
| D. | 锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com