
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
 |  |  |
| 图1 | 图2 | 图3 |
分析 (1)根据盖斯定律求解,焓变等于反应物的总键能减去生成物的总键能;
(2)根据平衡常数K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$计算,在温度相同时,该反应为正向气体体积减小的反应,增大压强,平衡正向移动,NO的平衡转化率增大;
(3)CO和NO转化为无毒物质,发生的反应为2CO+2NO=N2+2CO2,在电解池的阳极上发生失电子的氧化反应,在阴极上发生得电子的还原反应,根据电解池的工作原理进行回答;
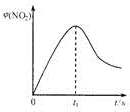
(4)该反应为放热反应,升高温度逆向移动,转化率下降;当$\frac{n({O}_{3})}{n(NO)}$>1时,NO2的物质的量减小,可能原因是O3将NO2氧化为更高价氮氧化物.
解答 解:(1)根据盖斯定律求解,CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1 ①;
N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1 ②;
CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H3 ③;
则③=①-②×2,△H3 =△H1 -2△H2=-890.3-2×(+180)=-1150kJ;
焓变等于反应物的总键能减去生成物的总键能,根据反应①,4(C-H)+2(O=O)-2(C=O)-4(O-H)=-890.3,C-H化学键键能E=-890.3-2×496+2×799+4×460=414kJ/mol;
故答案为:-1150;414;
(2)根据反应2CO (g)+2NO(g)═N2(g)+2CO2(g),平衡时NO的转化率为60%,
起始 1 1 0 0
变化 0.6 0.6 0.3 0.6
平衡 0.4 0.4 0.3 0.6
K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$=$\frac{0.3×0.{6}^{2}}{0.{4}^{2}×0.{4}^{2}}$=4.22 (mol/L)-1;
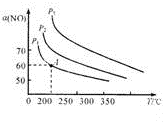
在温度相同时,该反应为正向气体体积减小的反应,增大压强,平衡正向移动,NO的平衡转化率增大,故P3>P2>P1;
故答案为:4.22 (mol/L)-1;P3>P2>P1;
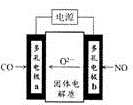
(3)①CO和NO转化为无毒物质,发生的反应为2CO+2NO=N2+2CO2,其中C的化合价升高,失电子,所以通入CO的电极a是阳极,②CO和NO转化为无毒物质,发生的反应为2CO+2NO=N2+2CO2,在阴极上发生得电子的还原反应即2NO+4e-=N2+2O2-,
故答案为:阳;2NO+4e-=N2+2O2-;
(4)该反应为放热反应,升高温度逆向移动,转化率下降;当$\frac{n({O}_{3})}{n(NO)}$>1时,NO2的物质的量减小,可能原因是O3将NO2氧化为更高价氮氧化物,
故答案为:该反应是放热反应;O3将NO2氧化为更高价氮氧化物(或生成了N2O5).
点评 本题考查学生电解池的工作原理以及电极反应式的书写知识,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | N2比O2的化学性质稳定 | B. | F2、Cl2、Br2、I2的沸点逐渐升高 | ||
| C. | 金刚石的熔点比晶体硅高 | D. | HF、HCl、HBr、HI的热稳定性依减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
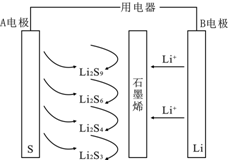 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | A电极上发生的一个电极反应为:2Li++6S+2e-=Li2S6 | |
| C. | 若对该电池充电,B电极接电源正极 | |
| D. | B电极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mol•L-1的KAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换产生44.8LH | |
| C. | 6.0g液态NaHS04中含有0.1NA个阳离子 | |
| D. | 1molH202分子中非极性共价键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
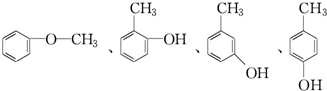
 ,B的结构简式
,B的结构简式 或
或 .
. ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0 | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验操作 | 现象 | 结论 | |
| A | 在淀粉溶液中加入稀硫酸加热一段时间后冷却至室温,再加入碘水. | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物中没有葡萄糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com