
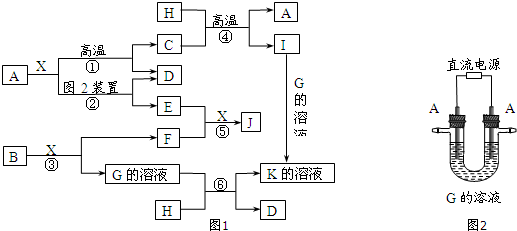
 .
.分析 A、D、F、H均为单质,X常温下为无色液体,且X能和A单质在高温下反应,则X是H2O,A是Fe,铁和水蒸气反应生成四氧化三铁和氢气,D是单质,则D是H2,C是Fe3O4,H是单质,且和四氧化三铁在高温下反应生成铁和I,该反应是铝热反应,则H是Al,I是Al2O3,B为淡黄色固体,能和水反应,则B是Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,F是单质,则F是O2,G是NaOH,K是NaAlO2,根据图知,E是Fe(OH)2,Fe(OH)2被氧气氧化生成J,J溶于酸得到黄色溶液,则J是Fe(OH)3,结合物质的性质分析解答.
解答 解:A、D、F、H均为单质,X常温下为无色液体,且X能和A单质在高温下反应,则X是H2O,A是Fe,铁和水蒸气反应生成四氧化三铁和氢气,D是单质,则D是H2,C是Fe3O4,H是单质,且和四氧化三铁在高温下反应生成铁和I,该反应是铝热反应,则H是Al,I是Al2O3,B为淡黄色固体,能和水反应,则B是Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,F是单质,则F是O2,G是NaOH,K是NaAlO2,根据图知,E是Fe(OH)2,Fe(OH)2被氧气氧化生成J,J溶于酸得到黄色溶液,则J是Fe(OH)3,
(1)B是Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其电子式为 ,
,
故答案为: ;
;
(2)E是Fe(OH)2,铁作阳极时,阳极上铁失电子发生还原反应,电极反应式为Fe-2e-+2OH-=Fe(OH)2;氢氧化亚铁是白色沉淀,氢氧化亚铁不稳定,易被氧化生成氢氧化铁红褐色沉淀,所以看到的现象是:白色沉淀迅速变成灰绿色,最后变为红褐色,
故答案为:Fe-2e-+2OH-=Fe(OH)2;白色沉淀迅速变成灰绿色,最后变为红褐色;
(3)反应①为高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,反应④属于铝热反应,反应的方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;
(4)反应⑥的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,当1mol水被还原时只转移1mol电子,所以当反应中转移3mol电子,被还原的水是3mol,
故答案为:3.
点评 本题考查了物质转化关系以及物质性质的综合应用,侧重于学生的分析能力的考查,为高考常见题型,明确常见反应是解本题关键,掌握铁、铝的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则二者的化学性质相同 | |
| C. | Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8 | |
| D. | 同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | Fe3+、Na+、C1-、NO3- | ||
| C. | K+、NH4+、Cl-、AlO2- | D. | Cu2+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于物质甲、乙的判断正确的是( )
已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于物质甲、乙的判断正确的是( )| A. | 甲是浓氨水,乙是浓硫酸 | B. | 甲是浓氨水,乙是浓硝酸 | ||
| C. | 甲是浓盐酸,乙是浓氨水 | D. | 甲是浓硝酸,乙是浓氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,C物质中所含化学键类型离子键、非极性共价键.
,C物质中所含化学键类型离子键、非极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com