
| X | Y | Z |
| W |
| A. | Z元素的常见化合价为:-1、-2 | |
| B. | X元素的氢化物的沸点一定比Z的低 | |
| C. | Y、Z、W形成的简单离子中,半径最小的是Z | |
| D. | Z元素的单质能从Na2W溶液中置换出W的单质 |
分析 由短周期元素X、Y、Z、W在周期表中的相对位置,X原子的最外层电子数为4,可知X为C,结合位置可知Y为N,Z为O,W为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为O,W为S,
A.Z为O,常见化合价为:-1、-2,故A正确;
B.X元素的氢化物的沸点不一定比Z的低,因X的氢化物可能为固态烃,故B错误;
C.Y、Z、W形成的简单离子中,W的电子层最多,且Y、Z具有相同电子排布,原子序数大的离子半径小,则半径最小的是Z,故C正确;
D.氧气可与硫化钠反应生成S,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子排布、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:实验题
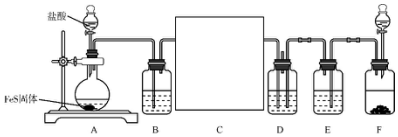

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

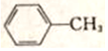 ,G的名称是苯甲醛.
,G的名称是苯甲醛.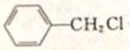 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$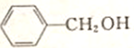 +NaCl.
+NaCl. .
. 以物质的量之比2:1反应得到化合物的结构简式为
以物质的量之比2:1反应得到化合物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在光分解催化剂存在下,利用太阳能分解水制H2 | |
| B. | 以焦炭和水为原料制水煤气后再分离出H2 | |
| C. | 以金属钠与水反应生成H2 | |
| D. | 由热电站提供电力电解水产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的汽油和甲烷燃烧,甲烷产生的热量比汽油多,因此甲烷更高效 | |
| B. | 产生相同热量所生成的二氧化碳,汽油比甲烷多,因此甲烷更低效 | |
| C. | 甲烷含碳量低,燃烧更充分,不易积炭,不易产生CO,因此更环保 | |
| D. | 等物质的量的汽油和甲烷燃烧,汽油产生的热量比甲烷多,因此更环保 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
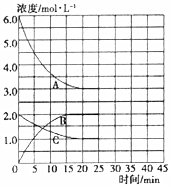 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2SO4与pH=12的NaOH等体积混合,所得溶液呈酸性 | |
| B. | 0.1mol/L的CH3COOH溶液在加水稀释过程中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$减小 | |
| C. | pH=5的NaHSO4溶液中水的电离程度小于纯水的电离程度 | |
| D. | 0.1mol/L的NaHCO3溶液中:c(OH-)═(H+)+2c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
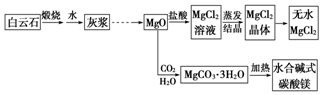 碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:
碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com