
【题目】将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是 ( )
A.c(H+) B.Ka(HF) C.![]() D.
D.![]()
【答案】D
【解析】
试题分析:HF溶液中存在电离平衡:HF![]() H++F-,则A.稀释促进电离,氢离子的物质的量增加,但c(H+)浓度增大,A错误;B.温度不变,Ka(HF)不变,B错误;C.稀释促进电离氢离子的物质的量增加程度大于氟离子,二者的比值减小,C错误;D.稀释促进电离,氢离子的物质的量增加,HF的物质的量减少,二者的浓度比值在,D正确,答案选D。
H++F-,则A.稀释促进电离,氢离子的物质的量增加,但c(H+)浓度增大,A错误;B.温度不变,Ka(HF)不变,B错误;C.稀释促进电离氢离子的物质的量增加程度大于氟离子,二者的比值减小,C错误;D.稀释促进电离,氢离子的物质的量增加,HF的物质的量减少,二者的浓度比值在,D正确,答案选D。
改变条件 | 平衡移 动方向 | n(H+) | c(H+) | c(CH3COO-) | c(CH3COOH) | 电离程度 | 导电力 | Ka |
加水稀释 | 向右 | 增大 | 减小 | 减小 | 减小 | 增大 | 减弱 | 不变 |
加入少量冰醋酸 | 向右 | 增大 | 增大 | 增大 | 增大 | 减小 | 增强 | 不变 |
通入HCl(g) | 向左 | 增大 | 增大 | 减小 | 增大 | 减小 | 增强 | 不变 |
加入NaOH(s) | 向右 | 减小 | 减小 | 增大 | 减小 | 增大 | 增强 | 不变 |
加入CH3COONa(s) | 向左 | 减小 | 减小 | 增大 | 增大 | 减小 | 增强 | 不变 |
加入镁粉 | 向右 | 减小 | 减小 | 增大 | 减小 | 增大 | 增强 | 不变 |
升高温度 | 向右 | 增大 | 增大 | 增大 | 减小 | 增大 | 增强 | 增大 |


科目:高中化学 来源: 题型:
【题目】【2017绍兴模拟】下列关于反应速率的说法错误的是( )
A.反应速率用于衡量化学反应进行的快慢
B.可逆反应达到化学平衡状态时,正、逆反应速率都为0
C.决定反应速率的主要因素是反应物的性质
D.增大反应物浓度,提高反应温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于气体摩尔体积的下列叙述中正确的是 ( )
A. 气体摩尔体积是单位物质的量的气体所占的体积
B. 标准状况下,气体摩尔体积约为22.4 L
C. 标准状况下,1 mol任何物质所占的体积约是22.4 L
D. 标准状况下,1 mol氢气所占的体积约是22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示反应 N2(g)+3H2(g) ![]() 2NH3(g);ΔH=-92.2kJ/mol。在某段时间 t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
2NH3(g);ΔH=-92.2kJ/mol。在某段时间 t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
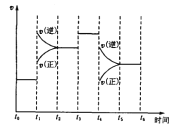
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017长宁区一模】不能用勒夏特列原理解释的是( )
A.使用铁触媒,加快合成氨反应速率
B.过量空气有利于SO2转化为SO3
C.打开汽水瓶盖,即有大量气泡逸出
D.配置FeCl3溶液时,加入少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:2NaOCN+3NaClO→Na2CO3+CO2↑+3NaCl+N2↑
完成下列填空:
(1)上述反应涉及的元素中,氮原子核外价电子数是______个;
O2—、Na+、Cl—中半径最小的是_____________。
(2)NaCN晶体中含有的化学键类型为_____________________________。
(3)第二段过程中,产物属于双原子分子的结构式是___________,该物质一般要比其他共价化合物如:NH3、H2S等都要稳定,其原因为:___________________;写出该物质的一种用途:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-10,下列叙述正确的是
=1×10-10,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合,所得混合溶液中水的电离得到促进
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现某些金属离子如 Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较 MnO2与 Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验。
请回答相关问题:
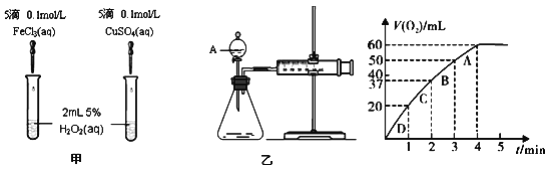
(1)定性分析:图甲可通过观察__________(填写相关实验现象), 定性比较得出结论。有同学提出将FeCl3 改为 Fe2(SO4)3 或者将 CuSO4 改为 CuCl2 更为合理,其理由是______________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。检查乙装置气密性的方法是_____________,实验中需要测量的数据是___________。
(3)加入0.10mol MnO2 粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①实验时放出气体的总体积是_______mL, 反应放出气体所需时间约为_________min。
②A、B、C、D各点反应速率快慢的顺序为 D>C>B>A.解释反应速率变化的原因:______________。
③计算 H2O2 的初始物质的量浓度为__________mol/L。(保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com