
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | SCN-、Fe3+、K+、Cl- |
分析 A.四种离子之间不反应,能够共存;
B.银离子与硫酸根离子反应;
C.铜离子、氢离子都与硫离子反应,硝酸根在酸性条件下具有强氧化性,能够氧化硫离子;
D.铁离子与硫氰根离子反应生成络合物硫氰化铁.
解答 解:A.NH4+、CH3COO-、Ca2+、Cl-之间不发生反应,在溶液中可以大量共存,故A正确;
B.Ag+、SO42-之间反应生成硫酸银,在溶液中不能大量共存,故B错误;
C.Cu2+、H+都与S2-反应,NO3-在酸性条件下能够氧化S2-,在溶液中不能大量共存,故C错误;
D.SCN-、Fe3+之间反应生成硫氰化铁,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| ① | 将Fe投入硫酸铜溶液中; | 验证Fe的金属性比Cu强. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:Fe3+、NH4+、Cl-、N03- | |
| B. | 水电离出的c(H+)=$\sqrt{{k}_{w}}$的溶液中:Na+、S042-、C032-、K+ | |
| C. | 由水电离的c(OH-)=1×10-2mol•L-1的溶液中:Cl-、CH3COO-、K+、AlO2- | |
| D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、N03-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氧化铝常被用于制作作耐火材料 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | Na2O2具有强氧化性,不能用作呼吸面具中的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,则一定有SO42- | |
| C. | 用NaOH溶液能鉴别Mg( NO3)2、Cu( NO3)2和NaNO3三种溶液 | |
| D. | 加入硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,一定有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
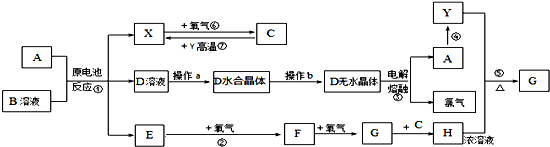
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | B. | 乙醇的分子式:C2H4O | ||
| C. | 四氯化碳的电子式: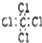 | D. | 异丁烷的结构简式:CH(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性强弱:R>W>X | |
| C. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| D. | Y与Z形成的两种化合物中阴、阳离子的个数比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com