
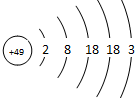
 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In在反应中容易失电子 | |
| B. | In为长周期元素 | |
| C. | In的最高价氧化物对应的水化物为强碱 | |
| D. | In为过渡元素 |
分析 由Tn原子结构示意图可知,Tn位于周期表第五周期ⅢA族,属于主族元素,属于长周期元素,金属性较强,其最高价氧化物对应的水化物为强碱.
解答 解:A.同主族元素从上到下元素的金属性逐渐增强,In具有比Al更强的金属性,在反应中容易失电子,故A正确;
B.元素周期表前三周期为短周期,由Tn原子结构示意图可知,Tn位于周期表第五周期ⅢA族,属于长周期元素,故B正确;
C.同主族元素从上到下元素的金属性逐渐增强,最高价氧化物对应的水化物的碱性增强,则其最高价氧化物对应的水化物为强碱,故C正确;
D.Tn位于周期表第四周期ⅢA族,属于主族元素,不属于过渡元素,故D错误;
故选D.
点评 本题考查元素的位置结构性质的相互关系应用,题目难度不大,本题注意过渡元素、长周期等概念的理解.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol的氢氧根离子所含电子数均为9 NA | |
| B. | 1.00 mol NaCl中含有NA个NaCl分子 | |
| C. | 常温常压下,92g的NO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| B. | 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
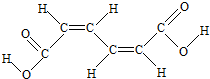
| A. | 已知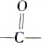 为平面结构,则该有机物分子中最多有16个原子在同一平面内 为平面结构,则该有机物分子中最多有16个原子在同一平面内 | |
| B. | 1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3 | |
| C. | 该有机物能发生加成反应不能发生取代反应 | |
| D. | 该有机物和乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜 | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 由反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,可得出C的非金属性强于Si | |
| D. | pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com