
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
A.v(N2)=0.25mol·Lˉ1·minˉ1 B.v(H2)=0.5mol·Lˉ1·minˉ1
C.v(NH3)=1mol·Lˉ1·minˉ1 D.v(NH3)=0.25mol·Lˉ1·minˉ1
科目:高中化学 来源: 题型:
【题目】据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:![]() 。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
A.①② B.③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:
用10mL H2O2制取150mLO2所需的时间(秒)
反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 260 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(1)该小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响。
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
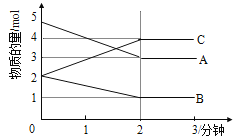
(3)该反应的的化学方程式为 。
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
回答下列问题:
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是 ___(只要求写出一种)。
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为 。
(3)气体II的主要成分除了Cl2外,还含有 。气体II常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有 。
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是 。
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl-4和Al2Cl-7两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取。某化学实验小组以8.0g TiO2和足量 CCl4为原料制取TiCl4。装置图如下:
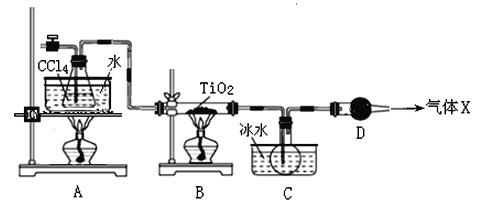
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题
(1)TiCl4中化学键的类型是 。
(2)B中TiO2发生反应的化学方程式是 。
(3)X气体的主要成分是 。
(4)实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
(5)欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
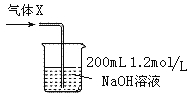
(6)若将反应过程中生成的气体X全部通入到下图所示的装置中充分反应,生成的盐是 (填化学式),生成盐的总物质的量n≤ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 |
X | 801 | 2427 | 3660 | 25026 | 32827 |
Y | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
根据上述信息:
①X和氯元素形成的简单分子的空间构型为 。
②Y的基态原子的核外电子排布式为 ,若Y和氯元素形成的分子的相对分子质量为267,请在下列方框中写出该分子的结构式(若存在配位键,用“→”表示)

(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是 ;


解释:②金刚石中的C-C的键长大于C60中C-C的键长的原因是 ;
③金刚石的熔点高于C60的原因是 ;
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.

①该化合物的化学式是 ;
②K层与C层之间的作用力是 ;
③K层中K原子之间的最近距离是C-C键的键长dC-C的 倍
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为 cm(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
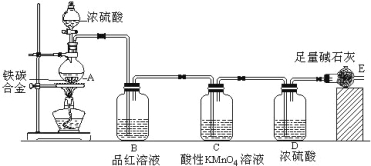
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)C装置的作用 。
(4)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是 。
A.A中反应不完全
B.E中碱石灰会吸收空气中的CO2和H2O
C.反应生成的SO2部分被E中碱石灰吸收
D.反应完全后,还有CO2气体滞留在装置体系中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同, A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1) B、C、D三种元素中电负性最大的元素其基态原子的电子排布图为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有________个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为______。该化合物的电子式为 。

(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。
②由H分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬顿( Fenton )试例,成分为双氧水和亚铁盐,需要酸性环境。电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图2所示.其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+·OH,生成的羟基自由基(·OH)对有机物有极强的氧化能力。下列说法正确的是

A.a极是电源的正极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-=·OH+H+
D.消耗1molO2,可以产生2mol·OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com