
| A. | C3H8,C4H6 | B. | C3H6,C4H6O2 | C. | C2H2,C6H6 | D. | CH4O,C2H4O2 |
分析 总物质的量一定,完全燃烧时生成的水的质量不变,则有机物中含H原子个数相同;消耗的氧气的质量不变,设有机物为CxHyOz,则x+$\frac{y}{4}$-$\frac{z}{2}$相同,以此来解答.
解答 解:A.H原子不同,总物质的量一定,完全燃烧时生成的水的质量不同,故A不选;
B.3+$\frac{6}{4}$≠3+$\frac{6}{4}$-$\frac{2}{2}$,消耗的氧气的质量不同,故B不选;
C.H原子不同,总物质的量一定,完全燃烧时生成的水的质量不同,故C不选;
D.H原子相同,且1+$\frac{4}{4}$-$\frac{1}{2}$=2+$\frac{4}{4}$-$\frac{2}{2}$,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗的氧气的质量不变,故D选;
故选D.
点评 本题考查有机反应的计算,为高频考点,把握有机物燃烧规律及原子守恒为解答的关键,侧重分析与计算能力的考查,注意总物质的量一定,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
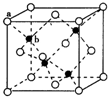 E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: (若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
(若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含3.01×1023个氮原子的N2 | B. | 标准状况下11.2 L H2 | ||
| C. | 1 mol Na2SO4中的Na+ | D. | 常温常压下32 g O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
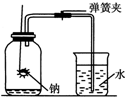 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
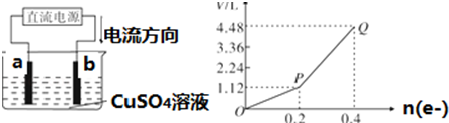
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | SiH4的沸点高于CH4,推测H2S的沸点高于H2O | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | Ca (OH) 2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )| A. | ① | B. | ①③ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com