
| A. | 原溶液中投入铁粉的物质的量是0.2mol | |
| B. | 原溶液中HNO3的浓度是1.5mol | |
| C. | 反应后的溶液中还可溶解7.2g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:1 |
分析 溶液质量增重为参加反应Fe的质量与生成NO的质量之差,再根据电子转移守恒列方程计算溶液中n(Fe2+)、n(Fe3+),进而计算该题.
解答 解:生成NO的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
设Fe2+、Fe3+的物质的量分别为xmol、ymol,
由溶液质量增重9.3g,则:(x+y)mol×56g/mol-0.25mol×30g/mol=9.3g,
由电子转移守恒,则:2xmol+3ymol=0.25mol×3,
联立方程,解得x=0.15、y=0.15,
反应后c(Fe2+):c(Fe3+)为=0.15:0.15=1:1,
A.原溶液中投入铁粉物质的量是0.15mol+0.15mol=0.3mol,故A错误;
B.n(HNO3)=2n(Fe2+)+3n(Fe3+)+n(NO)=2×0.15mol+3×0.15mol+0.25mol=1mol,c(HNO3)=$\frac{1mol}{0.5L}$=2mol/L,故B错误;
C.由反应2Fe3++Cu=2Fe2++Cu2+可知,还可溶解0.075molCu,质量为0.075mol×64g/mol=4.8g,故C错误;
D.由以上计算可知反应后的溶液中c(Fe2+):c(Fe3+)=1:1,故D正确;
故选D.
点评 本题考查氧化还原反应的计算、氧化还原反应基本概念,为高频考点,侧重于学生的分析能力和计算能力的考查,利用电子转移守恒计算,难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D C A B | B. | A D C B | C. | B A D C | D. | A D B C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | 氮 | Y | |
| X | 硫 | Z |
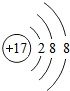 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 蛋白质可以通过烧焦时的特殊气味进行鉴别 | |
| C. | 乙烯和聚乙烯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com