
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2)D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是______________。
(4) 画出D的核外电子排布图_________________________________________,这样排布遵循了______________原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
【答案】F F 高 氨气分子间能形成氢键 第四周期第Ⅷ族  能量最低 泡利不相容 洪特
能量最低 泡利不相容 洪特 ![]()
【解析】
A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,则B为Na;C的最外层有三个成单电子,则C的3p能级有3个电子,C为P元素;C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E的核外电子排布式为1s22s22p63s23p63d64s2,E为Fe元素。依此解答该题。
(1) D为N元素,它位于元素周期表的第二周期,F的非金属性最强,所以第一电离能最大的元素是F,电负性最大的元素是F。答案为:F;F;
(2)D的氢化物为NH3,C的氢化物为PH3,NH3分子间能形成氢键,而PH3分子间不形成氢键,氢键的存在,增大了氨气分子间的作用力,使其沸点升高,所以NH3的沸点比PH3的沸点高,原因是氨气分子间能形成氢键。答案为:高;氨气分子间能形成氢键;
(3)E为Fe,核外电子排布式为1s22s22p63s23p63d64s2,在周期表的位置是第四周期第Ⅷ族。答案为:第四周期第Ⅷ族;
(4) D为N元素,电子排布式为1s22s22p3,核外电子排布图为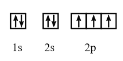 ,这样排布遵循了能量最低原理、泡利不相容原理和洪特规则。答案为:
,这样排布遵循了能量最低原理、泡利不相容原理和洪特规则。答案为: ;能量最低;泡利不相容;洪特;
;能量最低;泡利不相容;洪特;
(5)B为钠,与硫反应生成Na2S,电子式表示B的硫化物的形成过程: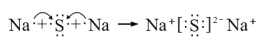 。答案为:
。答案为:![]() 。
。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D.标况下,11.2 L甲烷和乙烯的混合气体充分燃烧,所形成的O—H键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图所示。
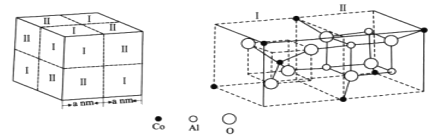
基态Co原子的价电子排布图为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示。下列说法正确的是( )

A.原子半径(r):r(X)>r(Z)
B.元素的非金属性:Y>M
C.Y元素的最高化合价为+7价
D.Z的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,![]() 与
与![]() 在多孔碳材料电极处生成
在多孔碳材料电极处生成![]() (
(![]() 或1)。下列说法正确的是
或1)。下列说法正确的是

A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断正确的是

A.最高正化合价:X<Y<Z<W
B.原子半径:W<X<Y<Z
C.气态氢化物的热稳定性:Z<W
D.最高价氧化物对应水化物的酸性:Z<W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com