
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g)  2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量 ( )
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量 ( )
A.等于0.3 mol
B.等于0.15 mol
C.小于0.15 mol
D.大于0.15 mol,小于0.3 mol
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
某有机物X能发生水解反应,水解产物为Y和Z。Y和Z的相对分子质量相同,化合物X可能是
A.甲酸乙酯 B.甲酸丙酯 C.乙酸甲酯 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
室温下,取0.3 mol·L-1HY溶液与0.3 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(OH-)=10-9 mol·L-1
B.溶液中离子浓度由大到小的顺序为c(Y-)>c(Na+)>c(OH-)>c(H+)
C.混合溶液中c(Na+)=c(Y-)+c(HY)=0.3 mol·L-1
D.混合溶液中c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
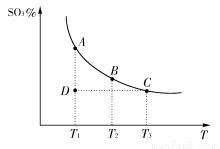
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)2SO2(g)+O2(g)  2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
(2)若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1________K2;若反应进行到状态D时,v正________v逆(填“>”“<”或“=”);
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
温度为T℃,压强为1.01×106 Pa条件下,某密闭容器中发生反应:A(g)+aB(?)  4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
A.第二次平衡时B为气态
B. a>3
C.第一次平衡后增大压强平衡向左移动
D.第三次达到平衡时B为非气态
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:填空题
某课外活动小组用如图装置进行实验,试回答下列问题。
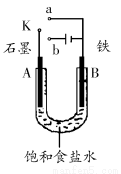
(1)若开始时开关K与a连接,则B极的电极反应式为________________。
(2)若开始时开关K与b连接,则B极的电极反应式为________,总反应的离子方程式为__________________________。
有关上述实验,下列说法正确的是(填序号)________________。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
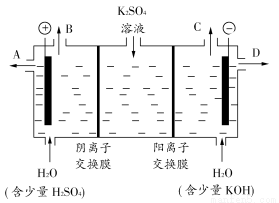
①该电解槽的阳极反应式为________________。此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)________导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因
______________________________________________________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
蝇类昆虫的雌性信息素可用芥酸(来自白芥)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为
C21H41COOH芥酸+X+4NaOH―→C23H46(雌性信息素)+2Na2CO3+2H2O+H2↑
则下列说法正确的是( )
A.X为C3H7COOH
B.电解的阳极反应式为C21H41COOH+X-2e-+2H2O=C23H46+CO32—+6H+
C.电解过程中阴极区pH增大,Na+向阴极移动
D.阴极的还原产物为H2和OH-
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:填空题
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:________。
(2)Cm-和E(m-1)-的还原性强弱为________>________,能证明其还原性强弱的离子方程式为________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为________。
(5)在B、C、E单质中,符合下列转化关系的是________。
单质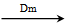 化合物一
化合物一 化合物二
化合物二 最高价氧化物
最高价氧化物
对应的水化物
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取4份100 mL该溶液分别进行如下实验:
实验
序号实验内容实验结果
A加AgNO3溶液有白色沉淀生成
B加足量NaOH溶液并加热收集到气体1.12 L(已折算成标准状况下的体积)
C加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g
D加少量KMnO4酸性溶液KMnO4溶液褪色
试回答下列问题:
(1)根据实验a判断Cl-是否存在________(填“一定存在”、“一定不存在”或“不能确定”)。
(2)该混合物中一定不存在的离子是_______________________________。
(3)①写出实验b中发生反应的离子方程式________。
②写出实验d中使KMnO4酸性溶液褪色的离子方程式________________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
|
|
|
|
|
|
(5)混合物中是否存在K+?________,判断的理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com