
根据所给仪器,回答下列回问题
(1)配置100g5%的氯化钠溶液,需要胶头滴管、药匙、托盘天平和上述仪器中的(填序号) ,量取液体时,由于读数时仰视造成所配溶液的溶质质量分数 (填“偏大”、“偏小”或“不变”)。
(2)在实验室,某同学要利用所给仪器制取一瓶氧气,应选用的仪器有(填序号) ,反应的化学方程式为 。若用如图所示的装置来收集该气体,气体应从 (填“a”或“b”)通入。

科目:高中化学 来源:2016届广东省等六校高三第一次联考化学试卷(解析版) 题型:填空题
(16分)甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)K(C)(填“>”、“=”或“<”).

③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字).
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序_______ _____
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为__________ .
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:实验题
(8分)某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:


反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是 。
(2)加入沸石的作用是 。
(3)分液漏斗使用前必须进行的操作是 。
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省佛山市高三上学期第一次月考化学试卷(解析版) 题型:选择题
氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
A.LiH的水溶液显中性 B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂 D.LiH中氢离子比锂离子的半径大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高一入学化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
B.硫酸氢钠溶液中加入足量的烧碱溶液:HSO4-+OH- = SO42-+H2O
C.过氧化钠与水反应:2O22-+2H2O = 4OH-+O2↑
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2 ===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三第一学期开学初检测化学试卷(解析版) 题型:填空题
[化学选修——2:化学与技术]我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、FeO、Fe2O3等。一种利用粉煤灰制取氧化铝、硫酸铁溶液、二氧化硅的工艺流程如下:

(1)操作i的名称为 。
(2)工业上若需加快粉煤灰与NaOH溶液反应的浸出速率,可采取的措施有 (写两点即可)。
(3)写出固体A溶解在稀硫酸中所得溶液与H2O2反应的离子方程式 。
(4)以上流程中可以循环利用的物质是 (填化学式)。
(5)某科研小组用硫酸作为浸取液,浸取粉煤灰中的铝元素和铁元素,在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在相同时,浸取率最高的是 (填化学式)。


(6)Al/AgO电池是一种新型安全电池,广泛用于军事领域,其电池总反应为:2Al + 3AgO + 2OH―+ 3H2O 2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省贵阳市高三8月摸底考试化学试卷(解析版) 题型:选择题
随着公路上汽车流量的迅速增长,交通事故频繁发生。汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞时发生反应:
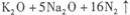 。下列判断正确的是
。下列判断正确的是
A.N2既是氧化剂又是还原剂
B.NaN3中N元素被还原
C.每生成16molN2转移30mole-
D.还原产物与氧化产物质量之比为l:15
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三秋季零诊考试化学试卷(解析版) 题型:实验题
(15分)某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
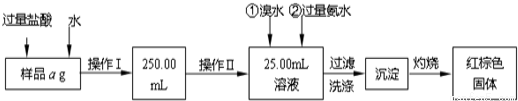
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式__________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是____________;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是_____。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不在用盐酸,为什么?
__________________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:__________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三期初考试化学试卷(解析版) 题型:选择题
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是:
A.密闭容器中CuO和C高温反应的气体产物: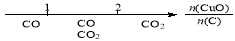
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝的存在形式: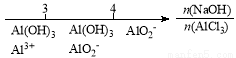
D.氨水与SO2反应后溶液中的铵盐: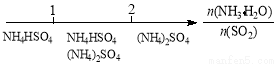
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com