
| A£®Na2CO3ŗĶNaHCO3ČÜŅŗÖŠ£ŗc(Na£«)£«c(H£«)£½c(OH£)£«c(HCO3£)£«c(CO32£) |
| B£®ĻąĶ¬Ģõ¼žĻĀ£¬pH=5µÄ¢ŁNH4ClČÜŅŗ”¢¢ŚCH3COOHČÜŅŗ”¢¢ŪĻ”ŃĪĖįČÜŅŗÖŠÓÉĖ®µēĄė³öµÄC(H+)£ŗ ¢Ł£¾¢Ś£¾¢Ū |
| C£®µČĪļÖŹµÄĮæµÄŅ»ŌŖČõĖįHXÓėĘä¼ŲŃĪKXµÄ»ģŗĻČÜŅŗÖŠ£ŗ2c(K£«)£½c(X£)£«c(HX) |
| D£®pH£½3µÄŅ»ŌŖĖįHXŗĶpH£½11µÄŅ»ŌŖ¼īMOHµČĢå»ż»ģŗĻ£ŗc(M£«)£½c(X£)£¾c(H£«)£½c(OH£) |
 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
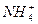 )·Ö±šĪŖa”¢b”¢c£Øµ„Ī»ĪŖmol”¤L-1£©,ŌņĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø £©
)·Ö±šĪŖa”¢b”¢c£Øµ„Ī»ĪŖmol”¤L-1£©,ŌņĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø £©| A£®a="b=c" | B£®c£¾a£¾b | C£®b£¾a£¾c | D£®a£¾c£¾b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®c(H£«)£¾c(OH-) |
| B£®c(CH3COOH)£«c(CH3COO-)=0.2mol”¤L-1 |
| C£®c(CH3COOH)£¾c(CH3CO1O-) |
| D£®c(CH3COO-)£«c(OH-)=0.1mol”¤L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĻņČÜŅŗÖŠ¼ÓČė“æCu½«Fe2+»¹Ō |
| B£®ĻņČÜŅŗÖŠĶØČėH2SŹ¹Fe2+³Įµķ |
| C£®ĻņČÜŅŗÖŠĶØČėCl2£¬ŌŁĶØČėCuO·ŪÄ©µ÷½ŚpHĪŖ4~5 |
| D£®ĻņČÜŅŗÖŠĶØČėCl2£¬ŌŁĶØČėNH3µ÷½ŚpHĪŖ4~5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®“æ¼īČÜŅŗČ„ÓĶĪŪ | B£®ĢśŌŚ³±ŹŖµÄ»·¾³ĻĀÉśŠā |
| C£®¼ÓČČĀČ»ÆĢśČÜŅŗŃÕÉ«±äÉī | D£®Ć÷·Æ¾»Ė® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®0.1mol”¤L-1µÄNa2CO3ČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµ£ŗc(Na+)=2 c(CO )+ c(HCO )+ c(HCO )+ c(H2CO3) )+ c(H2CO3) |
| B£®0.1mol”¤L-1µÄNH4ClŗĶ0.1mol”¤L-1µÄNH3”¤H2OµČĢå»ż»ģŗĻŗóČÜŅŗÖŠµÄĄė×ÓÅØ¶Č¹ŲĻµ£ŗ c(Cl£)> c(NH  )> c(OH£)> c(H+) )> c(OH£)> c(H+) |
| C£®³£ĪĀĻĀ£¬“×ĖįÄĘČÜŅŗÖŠµĪ¼ÓÉŁĮæ“×ĖįŹ¹ČÜŅŗµÄpH=7£¬Ōņ»ģŗĻČÜŅŗÖŠ£¬Ąė×ÓÅØ¶Č¹ŲĻµ£ŗ c(Na+)< c(CH3COO£) |
| D£®µČĪļÖŹµÄĮæÅØ¶Č”¢µČĢå»żµÄNH4NO3ŗĶKNO3ČÜŅŗÖŠ£¬Ē°ÕßµÄŃōĄė×ÓÅØ¶ČŠ”ÓŚŗóÕßµÄŃōĄė×ÓÅØ¶Č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
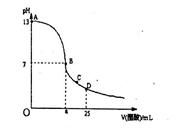
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ČÜÖŹĪŖNa2CO3 |
B£® |
C£® |
D£® |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com