
| A. | 合成纤维、光导纤维都是有机高分子材料 | |
| B. | 生活垃圾常采用露天焚烧或深埋的方法处理 | |
| C. | 工业废水经严格处理后可用于城市道路的保洁 | |
| D. | 工业上常用NaOH溶液在玻璃器皿上蚀刻标记 |
分析 A.光导纤维的成分是SiO2;
B.焚烧垃圾会产生污染;
C.工业废水经严格处理后,不会产生污染;
D.氢氧化钠溶液与玻璃中的二氧化硅反应非常缓慢.
解答 解:A.光导纤维的成分是SiO2,不是高分子,故A错误;
B.焚烧垃圾会产生污染,一般采用深埋的方法处理生活垃圾,故B错误;
C.工业废水经严格处理后,不会产生污染,可用于城市道路的保洁,能节约水资源,故C正确;
D.氢氧化钠溶液与玻璃中的二氧化硅反应非常缓慢,工业上常用HF溶液在玻璃器皿上蚀刻标记,故D错误;
故选C.
点评 本题综合考查了物质的性质和用途,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国的圆珠笔头一直需要进口笔尖钢,经过5年数不清的失败,2016年9月,中国太钢集团利用家常和面原理在钢水中加入添加剂试验成功,造出圆珠笔头,可完全替代进口.由此信息可知笔尖钢为合金,且具有良好的切削性 | |
| B. | 日前从中国建筑材料科学研究总院获悉,天宫二号采用了该院研发改进的新材料,耐辐射石英玻璃,其主要成分为硅 | |
| C. | 用废轮胎、废电缆打碎制成的塑胶跑道,可以提高原子利用率 | |
| D. | 塑化剂DEHP邻苯二甲酸二(2-乙基)己脂,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
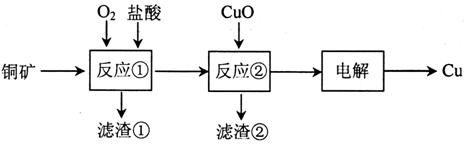
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
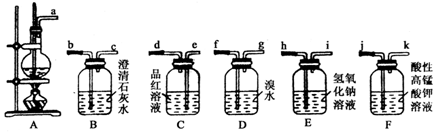
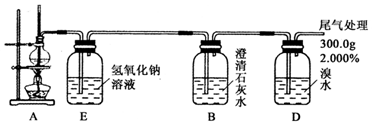
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:W<Z<X | |
| C. | Z与W、Y形成的化合物中,其化学键类型不相同 | |
| D. | 最高价氧化物的水化物的酸性:W<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
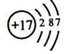 .
.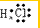 ;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为
;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为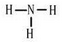 ,四种元素对应的化学性质最稳定的单质的电子式为
,四种元素对应的化学性质最稳定的单质的电子式为 .
.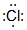 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中溶有苯酚(浓溴水,过滤) | B. | 溴苯中溶有溴(苯,分液) | ||
| C. | CO2中含有SO2(KMnO4酸性溶液,洗气) | D. | 乙醇中含有水(金属钠,蒸馏) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com