
分析 (1)取少量溶液于试管中,加入过量氢氧化钡溶液,无沉淀生成,说明溶液中无碳酸根离子和亚硫酸根离子;经加热,逸出的气体能够便湿润的红色石蕊试纸变蓝,说明溶液中存在铵根离子;
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银溶液,有白色沉淀生成,说明溶液中一定存在氯离子;
(3)通过上述实验,还无法确定的离子是钠离子,金属离子用焰色反应.
解答 解:(1)取少量溶液于试管中,加入过量氢氧化钡溶液,无沉淀生成,说明溶液中无碳酸根离子和亚硫酸根离子;经加热,逸出的气体能够便湿润的红色石蕊试纸变蓝,说明溶液中存在铵根离子,所以原溶液中一定存在的离子是铵根离子,一定不存在的离子是SO32-、CO32-,故答案为:NH4+;SO32-、CO32-;
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银溶液,有白色沉淀生成,说明溶液中一定存在氯离子,故答案为:Cl-;
(3)通过上述实验,还无法确定的离子是钠离子,金属离子用焰色反应,故答案为:Na+;用焰色反应来鉴别.
点评 本题考查了常见离子的检验,考查物质的检验有:常见阳离子的检验、常见阴离子的检验、常见气体的检验;要注意的是:焰色反应是元素的性质不是单质的性质.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
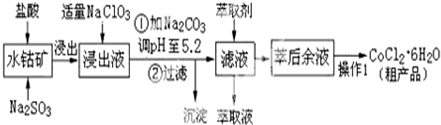
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com