
【题目】用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
A.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
C.滴定过程中,锥形瓶中有溶液溅出
D.酸式滴定管未用标准盐酸润洗
【答案】C
【解析】解:A.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故A错误; B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定,待测液的物质的量不变,V(标准)不变,根据c(待测)=
分析,可知c(待测)偏大,故A错误; B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定,待测液的物质的量不变,V(标准)不变,根据c(待测)= ![]() 分析,可知c(待测)不变,故B错误;
分析,可知c(待测)不变,故B错误;
C.滴定过程中,锥形瓶中有溶液溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)= ![]() 分析,可知c(待测)偏小,故C正确;
分析,可知c(待测)偏小,故C正确;
D.酸式滴定管未用标准盐酸润洗,标准盐酸被稀释,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故D错误;
分析,可知c(待测)偏大,故D错误;
故选C.
【考点精析】解答此题的关键在于理解酸碱中和滴定的相关知识,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


科目:高中化学 来源: 题型:
【题目】向物质的量浓度均为1mol/L的HCl、AlCl3、MgC12、NH4Cl混合溶液中逐滴加入1mol/L的NaOH溶液,得到如图图像。下列有关说法正确的是

A. 沉淀的最大物质的量为2mol
B. c-d段会产生标况下22.4LNH3
C. d-e段发生的反应为Al3++40H-=AlO2-+2H2O
D. 滴加NaOH溶液过程中,微粒反应的先后顺序是H+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的SO2和Cl2充分混合,通入加有品红的氯化钡溶液,可观察到的现象是( )
A.溶液快速褪色B.溶液缓慢褪色C.生成白色沉淀D.生成浅黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 2.4g金属镁所含电子数目为0.2NA
B. 16g CH4所含原子数目为NA
C. 17gNH3所含质子数目为17 NA
D. 18g水所含分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某溶液浸湿滤纸后置于集气瓶口,以检验瓶中是否收集满二氧化硫气体。则该溶液是( )
A.氯化钡溶液B.酸性高锰酸钾溶液
C.碘化钾淀粉溶液D.澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
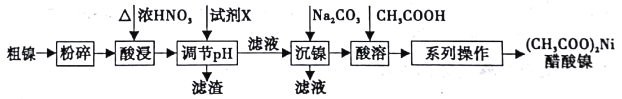
已知:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
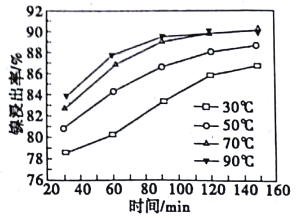
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。
(3)酸浸中Ni和浓硝酸反应的化学方程式为___________。
(4)加人试剂X为_____(填下列提供试剂的序号),可调节溶液pH至______(填pH范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)=2.0mol/L,若要处理1L该滤液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com