

| n |
| V |


科目:高中化学 来源: 题型:
 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+H2O?H2CO3 |
| B、OH-+HS-?S2-+H2O |
| C、HS-+H2O?H3O++S2- |
| D、HS-+H2O?H2S+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
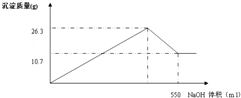
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)>c(Cl-)+c(OH-) |
| B、与pH=12的氨水等体积混合后所得溶液显酸性 |
| C、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| D、与0.01 mol?L-1乙酸钠溶液等体积混合后所得溶液中:c(Cl-)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、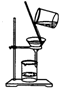 从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
B、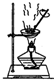 蒸发掉CuCl2溶液中部分水制得CuCl2?2H20晶体 |
C、 从CH3OH与C2H5OH的混合物中分离出乙醇 |
D、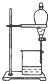 从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-241.8 kJ?mol-1 |
| B、-483.6 kJ?mol-1 |
| C、-285.8 kJ?mol-1 |
| D、-571.6 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com