
| 0.01mol/L×5×10-5 |
| 0.05L |
| 0.02mol/L×2×5×10-5L |
| 0.05L |
| 10-14 |
| 4×10-5 |
| 0.01mol/L×5×10-5 |
| 0.05L |
| 0.02mol/L×2×5×10-5L |
| 0.05L |
| 10-14 |
| 4×10-5 |


科目:高中化学 来源: 题型:
| A、乙醇、糖类和蛋白质都是人体必需的营养物质 |
B、NH4I的电子式: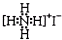 |
| C、石油是混合物,其分馏产品汽油也是混合物 |
| D、陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
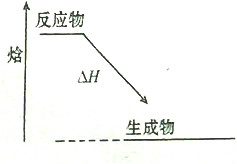
| A、① | B、④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体和溶液的本质区别是能否发生丁达尔效应 |
| B、酸性氧化物不一定是非金属氧化物,而碱性氧化物一定是金属氧化物 |
| C、离子键只存在于离子化合物中,共价键只存在于共价化合物中 |
| D、强电解质与弱电解质的分类依据是电解质水溶液导电能力的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳、硫元素在自然界中均存在多种同素异形体 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C、向饱和石灰水中加入少量CaO,振荡,恢复至室温后溶液的pH增大 |
| D、相同条件下,2 mol氢原子所具有的能量等于l mol氢分子所具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
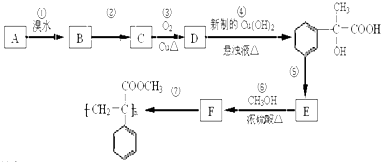
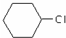 为原料合成重要的化工产品
为原料合成重要的化工产品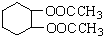 ,写出相应的合成路线流程图(无机试剂任用)
,写出相应的合成路线流程图(无机试剂任用)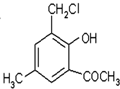 的同分异构体的结构简式:
的同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2ml | B、3ml |
| C、4ml | D、5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
| A、c (NH4+)>c (CO32-)>c (NH3?H2O)>c (HCO3-) |
| B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2 c(CO32-) |
| C、c (CO32-)+c (HCO3-)+c (H2CO3)=0.1 mol?L-1 |
| D、c (NH4+)+c (NH3?H2O)=2 c (CO32-)+2c (HCO3-)+2 c (H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com