
вбжЊЃК25ЁцЪБЃЌKa(HAc)=1.7ЁС10-5 mol /LЁЃЯжгаШчЯТШмвКЃК
Ђй0.1mol/LHAcгы0.1mol/LNaOHШмвКЕШЬхЛ§ЛьКЯвК
ЂкpH = 3ЕФHAcгыpH = 11ЕФNaOHШмвКЕШЬхЛ§ЛьКЯвК
Ђл0.1 mol /LH2SO4гы0.2mol/LNaOHШмвКЕШЬхЛ§ЛьКЯвК
ГЃЮТЪБЃЌШ§епpHДѓаЁЙиЯЕе§ШЗЕФЪЧ
AЃЎЂйЃОЂлЃОЂк BЃЎЂлЃОЂйЃОЂк CЃЎЂйЃОЂкЃОЂл DЃЎЂкЃОЂлЃОЂй
A
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКNaOHЪЧЧПМюЃЌHAcЪЧШѕЫсЁЃЂй0.1mol/LHAcгы0.1mol/LNaOHШмвКЕШЬхЛ§ЛьКЯвКЪБЧЁКУЭъШЋЗЂЩњЗДгІЕУЕНNaAcЁЃгЩгкNaAcЪЧЧПМюШѕЫсбЮЁЃдкШмвКжаAc-ЗЂЩњЫЎНтЗДгІЁЃAc-+H2O HAc+ OH-ЁЃЫљвдШмвКЯдМюадЁЃЂкpH = 3ЕФHAcШмвКc(H+)=10-3mol/L,гЩгкHAcЪЧШѕЫсЃЌВПЗжЕчРыЃЌЫљвдc(HAc) ЃО10-3mol/L pH = 11ЕФNaOHШмвК,c(OH-)=10-3mol/LЁЃШєЖўепЕШЬхЛ§ЛьКЯвКдђШмвКЮЊNaAcКЭHAcЕФЛьКЯШмвКЁЃгЩгкHAcЕФЕчРызїгУДѓгкAc-ЫЎНтзїгУЃЌЫљвдШмвКЯдЫсадЁЃЂл0.1 mol /LH2SO4гы0.2mol/LNaOH.вђЮЊH2SO4ЪЧЖўдЊЧПЫсЃЌNaOHЪЧвЛдЊЧПМюЃЌЫљвдСПШмвКжаЕФc(OH-)= c(H+)ШєЕШЬхЛ§ЛьКЯвКЃЌдђn(OH-)=n(H+).вђДЫШмвКЯджаадЁЃГЃЮТЪБЃЌШ§епpHДѓаЁЙиЯЕе§ШЗЕФЪЧЂйЃОЂлЃОЂкЁЃбЁЯюЮЊAЁЃ
HAc+ OH-ЁЃЫљвдШмвКЯдМюадЁЃЂкpH = 3ЕФHAcШмвКc(H+)=10-3mol/L,гЩгкHAcЪЧШѕЫсЃЌВПЗжЕчРыЃЌЫљвдc(HAc) ЃО10-3mol/L pH = 11ЕФNaOHШмвК,c(OH-)=10-3mol/LЁЃШєЖўепЕШЬхЛ§ЛьКЯвКдђШмвКЮЊNaAcКЭHAcЕФЛьКЯШмвКЁЃгЩгкHAcЕФЕчРызїгУДѓгкAc-ЫЎНтзїгУЃЌЫљвдШмвКЯдЫсадЁЃЂл0.1 mol /LH2SO4гы0.2mol/LNaOH.вђЮЊH2SO4ЪЧЖўдЊЧПЫсЃЌNaOHЪЧвЛдЊЧПМюЃЌЫљвдСПШмвКжаЕФc(OH-)= c(H+)ШєЕШЬхЛ§ЛьКЯвКЃЌдђn(OH-)=n(H+).вђДЫШмвКЯджаадЁЃГЃЮТЪБЃЌШ§епpHДѓаЁЙиЯЕе§ШЗЕФЪЧЂйЃОЂлЃОЂкЁЃбЁЯюЮЊAЁЃ
ПМЕуЃКПМВщЕШЬхЛ§ЫсЁЂМюШмвКЛьКЯЪБЕФpHДѓаЁЙиЯЕЕФжЊЪЖЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьМЊСжЪЁИпвЛНЬбЇЦРЙРЃЈвЛЃЉЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТБэЫљСаИїзщЮяжЪжаЃЌЮяжЪжЎМфЭЈЙ§вЛВНЗДгІОЭФмЪЕЯжШчЭМЫљЪОзЊЛЏЕФЪЧ
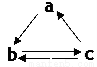
abc
AAlAlCl3AlЃЈOHЃЉ3
BHNO3NONO2
CSiSiO2H2SiO3
DSO3H2SO4S
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьдЦФЯЪЁИпвЛЯТбЇЦкЕквЛДЮдТПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
гУвЛГфТњАБЦјЕФЩеЦПзіХчШЊЪЕбщЃЌЕБЫЎГфТњећИіЩеЦПКѓЃЌЩеЦПФкАБЫЎЕФЮяжЪЕФСПХЈЖШЪЧЃЈАДБъзМзДПіЯТМЦЫуЃЉ( ЃЉ
AЃЎ0.045 molЁЄLЃ1 BЃЎ1 molЁЄLЃ1
CЃЎ0.029 molЁЄLЃ1 DЃЎВЛФмШЗЖЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьдЦФЯЪЁИпвЛЯТбЇЦкЕквЛДЮдТПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТСаБэДяЗНЪНДэЮѓЕФЪЧЃЈ ЃЉ
AЃЎHЁУCl BЃЎ CЃЎ
CЃЎ DЃЎOЃНCЃНO
DЃЎOЃНCЃНO
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2015НьИЃНЈЪЁСњбвЪаИпЖўЕквЛбЇЦкНЬбЇжЪСПМьВтЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЩйСПЖўбѕЛЏЬМЭЈШыNaCNШмвКжаЃЌЗЂЩњШчЯТЗДгІЃКCO2 + H2O + CN- =HCO3- + HCNЁЃвдЯТЫЕЗЈе§ШЗЕФЪЧЃЈЮТЖШОљЮЊ25ЁцЃЉ
AЃЎЕчРыГЃЪ§ЃКK(HCN) ЃМKa2 (H2CO3)
BЃЎХЈЖШОљЮЊ0.1molЁЄL-1ЕФNaCNКЭNaHCO3ШмвКЕФpHЃКNaCN ЃМNaHCO3
CЃЎХЈЖШОљЮЊ0.1molЁЄL-1ЕФNaCNКЭNa2CO3ШмвКжаЃЌвѕРызгзмХЈЖШЯрЕШ
DЃЎpHОљЮЊ10ЕФ Na2CO3ШмвКЁЂNaCNШмвКжаЃЌЫЎЕчРыВњЩњЕФcЃЈOH-ЃЉЯрЕШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2015НьИЃНЈЪЁСњбвЪаИпЖўЕквЛбЇЦкНЬбЇжЪСПМьВтЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
вбжЊЃКN2(g)+3H2(g) ? 2 NH3(g) ЁїH = -92.4 kJ/molЁЃвЛЖЈЬѕМўЯТЃЌЯжгаШнЛ§ЯрЭЌЧвКуШнЕФУмБеШнЦїМзгыввЃКЂй ЯђМзжаЭЈШы1 mol N2КЭ3 mol H2ЃЌДяЕНЦНКтЪБЗХГіШШСПQ1 kJЃЛЂк ЯђввжаЭЈШы0.5 mol N2 КЭ1.5 mol H2ЃЌДяЕНЦНКтЪБЗХГіШШСПQ2 kJЁЃдђЯТСаЙиЯЕЪНе§ШЗЕФЪЧ
AЃЎ92.4ЃОQlЃО2Q2 BЃЎ92.4ЃНQ1ЃМ2Q2
CЃЎQ1ЃН2Q2ЃН92.4 DЃЎQ1ЃН2Q2ЃМ92.4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2015НьИЃНЈЪЁЫФЕиСљаЃИпЖўЯТбЇЦкЕквЛДЮдТПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКЬюПеЬт
ЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗж, еыЖдБэжаЕФЂйЁЋЂтжждЊЫи,ЬюаДЯТСаПеАз:
жїзх жмЦк | ЂёA | ЂђA | ЂѓA | ЂєA | ЂѕA | ЂіA | ЂїA | 0зх |
1 | Ђй |
|
| |||||
2 |
|
|
| Ђк | Ђл | Ђм |
|
|
3 | Ђн |
| Ђо |
| Ђп |
| Ђр | Ђс |
4 | Ђт |
|
|
|
|
|
|
|
ЃЈ1ЃЉаДгЩЩЯЪідЊЫизщГЩЕФЗжзгжаЕчзгзмЪ§ЮЊ10ЕФЗжзгЃЈжСЩйСНжжЃЉЃК ЁЃ
ЃЈ2ЃЉБШНЯЃКЂкЁЂЂлЁЂЂмЁЂЂнЕФЕквЛЕчРыФмЃК ЃО ЃО ЃО ЃЈаДдЊЫиЗћКХЃЉЁЃ
ЃЈ3ЃЉдкзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяжаЃЌЫсадзюЧПЕФЛЏКЯЮяЕФЗжзгЪНЪЧ ЃЛМюадзюЧПЕФЛЏКЯЮяЕФЕчзгЪНЪЧ:
ЃЈ4ЃЉОпгаСНадЕФзюИпМлбѕЛЏЮяЪЧ (ЬюЛЏбЇЪН)ЃЛаДГіЦфгыЧтбѕЛЏФЦШмвКЗДгІЕФРызгЗНГЬЪНЃК ЁЃ
ЃЈ5ЃЉЯТБэЮЊдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкдЊЫиAЁЋEЕФЕквЛЕНЕкЮхЕчРыФмЪ§ОнЁЃ
ЕчРыФмI(eV)AB C D E
I111ЃЎ313ЃЎ65ЃЎ27ЃЎ66ЃЎ0
I224ЃЎ435ЃЎ149ЃЎ315ЃЎ018ЃЎ8
I347ЃЎ954ЃЎ971ЃЎ680ЃЎ128ЃЎ4
I464ЃЎ577ЃЎ498ЃЎ9109ЃЎ2112ЃЎ0
I5392ЃЎ1113ЃЎ9138ЃЎ3141ЃЎ3153ЃЎ7
ЪдЛиД№ЃКБэжаПЩФмЮЊЗЧН№ЪєдЊЫиЕФЪЧ ЃЈЬюзжФИЃЉЃЛШєDЁЂEЮЊЭЌжмЦкЯрСкдЊЫиЃЌБэжаDБШEЕФЕквЛЕчРыФмТдДѓЃЌЦфдвђЪЧ ЁЁЁЁЁЁ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2015НьИЃНЈЪЁЫФЕиСљаЃИпЖўЯТбЇЦкЕквЛДЮдТПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
Н№ЪєЕФЯТСааджЪжагыН№ЪєОЇЬхНсЙЙЮоЙиЕФЪЧЃЈ ЃЉ
AЃЎЕМЕчад BЃЎЛЏбЇЗДгІжавзЪЇШЅЕчзг
CЃЎбгеЙад DЃЎгВЖШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2015НьКўББЪЁЛЦЪЏЪаИпЖўЩЯбЇЦкЦкФЉПМЪдЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЖдpHжЕЯрЭЌЕФбЮЫсКЭДзЫсСНжжШмвКЕФЫЕЗЈе§ШЗЕФЪЧ
AЃЎжаКЭМюЕФФмСІЯрЭЌ BЃЎбЮЫсКЭДзЫсЕФЮяжЪЕФСПХЈЖШЯрЭЌ
CЃЎOH-ЕФЮяжЪЕФСПХЈЖШЯрЭЌ DЃЎH+ЕФЮяжЪЕФСПХЈЖШВЛЭЌ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com