
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有6个δ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子中既存在极性键又存在非极性键 | |
| D. | 丙烯分子中所有原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①制备SO2 | B. | 用装置②检验和收集SO2 | ||
| C. | 用装置③稀释反应后溶液 | D. | 用装置④测定反应后溶液中c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
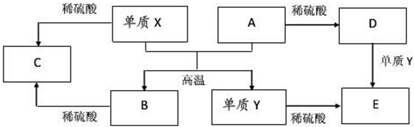
| A. | 单质X与A反应的化学方程式:Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| B. | 检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 单质X和单质Y在一定条件下均能与水发生置换反应 | |
| D. | 由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AB(g)?A2(g)+B2(g)△H>0 | B. | A2(g)+3B2(g)?2AB3(g)△H<0 | ||
| C. | A(s)+B(g)?C(g)+D(g)△H>0 | D. | 2A(g)+B(g)?3C(g)+D(s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com