
【题目】下列物质的分子或晶体中包含正四面体结构,且键角不等于109o28’的是( )
A.白磷
B.金刚石
C.氨气
D.甲烷
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下,等体积 、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
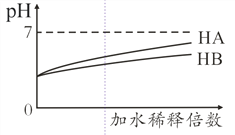
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)> c(A-)> c(H+) > c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四位科学家都对原子结构的认识起到过重要的推动作用,其中首先提出原子核外的电子在一系列的轨道上运动的是( )
A. 汤姆生 B. 道尔顿 C. 波尔 D. 卢瑟福
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 标准状况下,33.6LSO3中含有硫原子的数目为1.5NA
B. 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 50mL,18.4mol/L浓硫酸与足量铜充分反应,生成SO2分子的数目为0.46NA
D. 某密闭容器盛有1molO2和2molSO2,在一定条件下充分反应,转移电子的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 自发反应一定是熵增大,非自发反应一定是熵减小或不变
B. 自发反应在恰当条件下才能实现
C. 自发反应在任何条件下均能实现
D. 同一物质的固、液、气三种状态的熵值相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:__________________________。
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是_______(写电子式)。
(3).已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知道12.0 g碳完全燃烧,放出热量为b kJ。则热化学方程式C(s)+![]() O2(g)===CO(g) ΔH=w,
O2(g)===CO(g) ΔH=w,
w等于 _____________
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平) 回答问题:
①还原产物的化学式为 _______________;
②配平后的化学方程式是 ________________________________ 。
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。

图中阴极为______(填“A”或“B”)。
若C处不通入O 2 ,D、E处分别收集到11.2L和4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为___________(忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。 通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞试液变红的原因___________________,依据实验现象推测红色褪去的原因是________________。
②加入MnO2反应的化学方程式为_______________________。
(2)实验小组两名同学共同设计如下装置探究过氧化钠与二氧化硫的反应。通入SO2,将带余烬的木条插入试管C中,木条复燃。

请回答下列问题:
甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:_________________________,检验反应后B中的白色固体含有Na2SO3的方法是:___________________________。
乙同学认为反应的后B中有Na2SO3还会有Na2SO4。乙同学猜想的理由是:______________________。
为检验产物中Na2SO4的存在乙同学设计并实施了如下实验方案:

甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为_________________________。
③请补充完整实验小组测定B中反应完全后固体组成的实验方案。称取样品a 克加水溶解,__________,烘干,称量沉淀质量为b 克,计算含量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2相对分子质量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式:CO32-+2H2+=CO2↑+H2O表示 ( )
A.碳酸盐和盐酸盐之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与酸之间的反应
D.可溶性碳酸盐与强酸之间的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com