
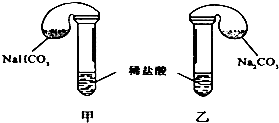
 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
分析 (1)甲装置发生反应HCO3-+H+═H2O+CO2↑,乙装置发生反应CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,据此判断反应速率大小;
(2)根据n=$\frac{m}{M}$分别计算出碳酸氢钠、碳酸钠的物质的量,再根据n=cV计算出盐酸中含有HCl的物质的量,然后根据反应方程式判断过量情况,从而可知甲和乙的反应现象及原因.
解答 解:(1)甲装置发生反应为:HCO3-+H+═H2O+CO2↑,乙装置发生反应为:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,甲装置内反应速率较快,单位时间产生的CO2多,故甲装置中的气球体积先变大,
故答案为:甲;HCO3-+H+═H2O+CO2↑;
(2)第②组中碳酸氢钠的物质的量为:$\frac{42g}{84g/mol}$=0.5mol,碳酸钠的物质的量为:$\frac{53g}{106g/mol}$=0.5mol,300mL3 mol/L盐酸中含有HCl的物质的量为:3mol/L×0.3L=0.9mol,则n(NaHCO3)=n(Na2CO3);
0.5mol碳酸氢钠完全反应消耗0.5molHCl,而0.5mol碳酸钠完全反应消耗1molHCl,显然甲中盐酸过量,乙中盐酸不足量,则甲乙装置中放出二氧化碳的体积大小为:V(CO2)甲>V(CO2)乙,所以甲中气球比乙中气球的体积大,
故答案为:甲中气球比乙中气球的体积大;甲中盐酸过量,乙中盐酸不足量、n(NaHCO3)=n(Na2CO3)、V(CO2)甲>V(CO2)乙.
点评 本题考查了碳酸钠、碳酸氢钠的性质,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握碳酸钠、碳酸氢钠的化学性质,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
利用如图装置测定中和热的实验步骤如下:

①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)如右图所示,仪器A的名称是_______________;
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃[ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则C H3COOH在水溶液中电离的ΔH等于_________
H3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1
C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 某溶液中滴加盐酸能产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含CO32- | |
| D. | 向某溶液中加入BaCl2溶液出现白色沉淀,再加入HCl溶液,白色沉淀不溶解,则该溶液中肯定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 亚硫酸钠水解的离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{18}{{N}_{A}}$ | B. | $\frac{18}{{N}_{A}}$g•mol-1 | C. | 18NA g | D. | $\frac{18}{{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4?Na++H++SO42- | B. | HCO3-+H2O═H3O++CO32- | ||
| C. | HClO═H++ClO- | D. | H2S?H++HS- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com